|
|
Уравнение реакции окисления металлов кислородом12 в общем виде:
nM +
Условие возможности газовой коррозии - энергия Гиббса реакции меньше нуля: DGкор< 0.
Изотерма Вант Гоффа: Dr G = Dr G0 – Где - DrG0 - стандартная энергия Гиббса реакции = стандартной энергии Гиббса образования оксидов металлов ( DfG0298 , приведены в табл.); - ! для подавляющего большинства металлов DfG0298 <0 Þ возможна эта реакция химической коррозии при DrGТ > 0–коррозия термодинамически невозможна - при очень низких давлениях кислорода и высоких температурах. Задача 1. Определите термодинамическую возможность пароводяной коррозии изделия из низкоуглеродистой стали при 600оС под действием пара (р = 5). Fе + Н2О(г) = Н2 + FеО
Решение Допустим, что водород выделяется под атмосферным давлением: _ _ _ DrG = DrG0 +RT ln (рН2/рН2О) = DrH0 -TDrS0– RTln рН2О
DrH0T ≈ DrH0298 = -21,84 кДж ; DrS0T ≈ DrS0298 = -26,5 Дж/К DrG0600 = - 21840 – 873 (-26,5) = 1303 Дж> 0 - процесс невозможен
DrG600 = 1303 – 8,31.873 ln5 = 1303 – 11659 = -10356 Дж < 0 - процесс возможен! Задача 2. Определите, при каких давлениях паров воды рН2О прекращается пароводяная коррозия углеродистой стали при 600оС. Решение Химическая коррозия прекращается при DGкор≥ 0 Þ ln рН2О ≤ DrG0/RT ≤1303/8,31.873 ≤ 0,1798 т.е. при рН2О ≤ 1,198 атм. коррозия прекращается.
Таким образом, большинство металлов в атмосфере агрессивных газов могут подвергаться химической коррозии. Термодинамика указывает лишь на возможность протекания коррозионных процессов, но не может предсказать их скорость.
Кинетика химической коррозии.
Скорость окисления металла vхим.кор зависит от ►скорости собственно химической реакции ►скорости диффузии окислителя или ионов через коррозионную пленку. Защитное действие пленки тем больше, чем лучше ее сплошность и выше сопротивление диффузии. Сплошность пленки на поверхности металла можно приближенно оценить по соотношению между объемами продуктов коррозии и металла
a = Vок/VМ
► Металлы, у которых a < 1, не могут создавать сплошные оксидные слои Þ через несплошности в слое газ-окислитель (кислород) свободно проникает к поверхности металла. ► Сплошные и устойчивые оксидные слои образуются при значениях коэффициента a = 1,2 - 1,6. ► При больших значениях a пленки получаются не сплошные, легко отделяющиеся от поверхности металла (например, железная окалина), в результате возникающих внутренних напряжений. Однако - для хрома a = 2,02, но пленка оксидов устойчива к действию окружающей среды.
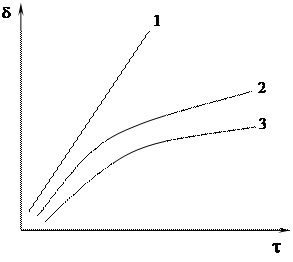
Зависимость роста толщины пленок d от времени t различна для разных металлов. Три основных типа зависимости d = f (t): Линейный, Параболический 3) логарифмический.
1)Линейная зависимость Þ скорость окисления постоянна d = k1t + const окислитель свободно проникает к поверхности через трещины и поры в оксидной пленке. Для таких металлов обычно a < 1. Наблюдается для щелочных и щелочно-земельных металлов. Для ванадия, вольфрама и молибдена при высоких температурах. 2) Параболическая зависимость Þ справедливо для пленок с хорошими защитными свойствами при a > 1 Þ скорость роста пленки определяется диффузией ионов и миграцией электронов через пленку d2 = 2k2t + const
Для многих металлов: Cu, Ni, Fe, Co, Mn и др. 3) Логарифмическая зависимость Þ для относительно тонких защитных пленок на начальных стадиях окисления или при низкотемпературном окислении d = k3 lnt + const
Например, Сu, Fe, Zn, Ni, Рb, Сd, Sn, Мn, Аl, Тi, Та. Высокие защитные свойства при низких температурах, пассивация металла. Различают пленки: ● Тонкие - от толщины монослоя молекул до 40 нм; на поверхности металла невидимы. ● Средние - толщины порядка 40 - 50нм; видимые вследствие их окраски. ● Толстые - значительные толщины ( окалина на стали, толстослойные анодные пленки на алюминиевых сплавах). Наиболее высокими защитными свойствами обладает сплошная, достаточно тонкая прочная и эластичная пленка, имеющая хорошее сцепление с металлом и одинаковый с ним коэффициент линейного расширения и возникающая на его гладкой поверхности. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 O2 = MnOm
O2 = MnOm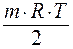 ln
ln 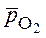 =Dr H0 -TDr S0–
=Dr H0 -TDr S0– 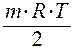 ln
ln 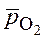
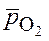 - относительное парциальное давление кислорода;
- относительное парциальное давление кислорода; = 1 (стандартном давлении кислорода).
= 1 (стандартном давлении кислорода).