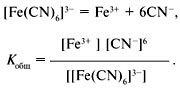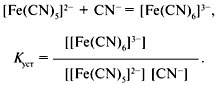|
|
ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ12 Растворяясь в воде, комплексные соли ведут себя как обычные соли – они диссоциируют на комплексный ион внутренней сферы и ионы внешней сферы: K3[Fe(CN)6] = 3К+ + [Fe(CN)6]3–. Водным растворам комплексных солей присущи все свойства электролитов: понижение давления пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания, осмотическое давление, электропровод-ность и др. По свойствам водных растворов комплексных солей можно установить состав внешней сферы соединения. Комплексный ион диссоциирует как слабый электролит, но эта диссоциация отличается тем, что координационное число комплексообразователя (центрального иона металла) сохраняется постоянным за счет замены лиганда (молекулы или иона, связанных с центральным ионом в комплексном соединении) молекулой воды: [Fe(CN)6]3– + Н2О = [Fe(CN)5Н2О]2– + CN–, [Fe(CN)5Н2О]2– + Н2О = [Fe(CN)4(Н2О)2]– + CN–, [Fe(CN)4(Н2О)2]– + Н2О = [Fe(CN)3(Н2О)3] + CN–, [Fe(CN)3(Н2О)3] + Н2О = [Fe(CN)2(Н2О)4]+ + CN–, [Fe(CN)2(Н2О)4]+ + Н2О = [Fe(CN)(Н2О)5]2+ + CN–, [Fe(CN)(Н2О)5]2+ + Н2О = [Fe(Н2О)6]3+ + CN–. Формулы молекул воды во внутренней сфере комплексного соединения часто не записывают. При ступенчатой диссоциации комплексного иона происходит изменение его заряда, на одной из ступеней образуется нейтральная молекула и конечным результатом диссоциации является образование иона [Fe(Н2О)6]3+, формулу которого мы обычно записываем привычным нам способом без молекул воды – Fe3+. Таким образом, диссоциация комплексного иона – это замещение лиганда на молекулу растворителя (воды). Равновесия диссоциации комплексных ионов подчиняются всем правилам смещения ионных равновесий. Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости. Для записи константы нестойкости К уравнение диссоциации составляется обычным способом (без участия молекул воды):
Аналогично составляются выражения для К3, К4, К5, К6, в которых квадратными скобками обозначены равновесные концентрации ионов. Если справочные данные по ступенчатым константам нестойкости отсутствуют, пользуются общей константой нестойкости комплексного иона:
Общая константа нестойкости равна произведению ступенчатых констант нестойкости. В аналитической химии вместо констант нестойкости в последнее время пользуются константами устойчивости комплексного иона:
Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест. Константа устойчивости характеризует равновесие образования комплекса. Константы нестойкости или константы устойчивости определяются различными физико-химическими методами. Использование химических методов затруднено, т.к. измерение равновесных концентраций веществ часто приводит к смещению равновесия. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт №1. Получение аммиаката меди. 2CuSO4 + 2NH4OH = ↓(CuOH)2SO4 +(NH4) 2SO4 голубой + ↓(CuOH)2SO4 +10NH4OH = 2[(Cu(NH3)4](OH)2 + (NH4) 2SO4+ 8H2O 2CuSO4 + 12NH4OH = 2[(Cu(NH3)4](OH)2 +2(NH4)2SO4+ 8H2O интенсивный синий цвет Cu2++ 6NH4OH =[Cu(NH3)4]2++ 2OH-+2NH4++ 4H2O [(Cu(NH3)4](OH)2 ↔ [Cu(NH3)4]2++ 2OH- [(Cu(NH3)4]2+↔ Cu2++ 4NH3 [Cu2+][ NH3]4 Kнест= [[Cu(NH3)4]2+]
Опыт №2. Получение аммиаката никеля. 2NiSO4 + 2NH4OH = ↓(NiOH)2SO4 +(NH4) 2SO4 зеленоватый + ↓(NiOH)2SO4 +14NH4OH = 2[Ni (NH3)6](OH)2 + (NH4) 2SO4+ 12H2O
NiSO4 + 8NH4OH = [Ni(NH3)6 ](OH)2 + (NH4)2SO4+ 6H2O Ni2++ 8NH4OH =[ Ni(NH3)6]2++ 2OH-+2NH4++ 6H2O Опыт №3. Получение аммиаката серебра. AgNO3 + KCl = AgCl + KNO3 AgCl + 2NH4OH = = [(Ag(NH3)2]Cl + 2H2O [(Ag(NH3)2]Cl ↔ [(Ag(NH3)2]++ Cl- [(Ag(NH3)2]+↔Ag++ NH3 [Ag+][ NH3]2 Kнест= [[Ag (NH3)2]+]
[(Ag(NH3)2]Cl + 2HNO3 = 2NH4NO3 + AgCl↓ белый [(Ag(NH3)2]++ Cl-+2H+= 2NH4++ AgCl↓
[(Ag(NH3)2]Cl + KI + 2H2O = AgI↓+ KCl +2NH4OH желтый Так как диссоциация комплексного иона является процессом обратимым, то уводя из сферы реакции посылаемые им ионы, можно практически разрушить комплекс. HNO3 связывает молекулы (NH3 + Н+= NH4+), уводя NH3 из сферы действия. В результате увеличивается концентрация [Ag+]. Опыт №4. Получение кобальтирадонитааммония. + изоамиловый спирт CoCl2 +NH4CNS (сух). = (NH4)2[(Co(CNS)4] + 2NH4Cl голубое кольцо Опыт №5. Получение фторидного комплекса железа. FeCl3 + 3NH4CNS (сух). = Fe(CNS)3 + 3NH4Cl красное окрашивание Fe(CNS)3 + 6NaF = Na3[FeF6] + 3NaCNS бесцветный Опыт №6. Получение берлинской лазури. 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 ↓+ 12KCl синий 4Fe3+ +3[Fe(CN)6]4- = Fe4[Fe(CN)6]3 ↓ Опыт №7. Получение турнбулевой сини. 3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 ↓+ 3K2SO4 синий 3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2 ↓ ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ Задание №1. В комплексном соединении укажите: - центральный атом, - лиганды, - внутреннюю и внешнюю сферы. Задание №2. Для данного комплексного соединения запишите: -заряд центрального иона, лигандов и комплекса; - координационное число. Задание №3. По химической формуле комплексного соединения: -назовите это соединение; - укажите, к какому классу комплексов относится комплексная частица, входящая в состав соединения; - к какому классу химических веществ относится это соединение. Задание №4. - Запишите электронную конфигурацию комплексообразова-теля ( атома и иона); - Определите гибридизацию связи в комплексе. Задание №5. По названию комплексного соединения напишите его формулу и укажите: -к какому классу комплексов относится комплексная частица, входящая в состав соединения; - к какому классу химических веществ относится это соединение. Варианты заданий
ЛИТЕРАТУРА 1. Коровин, Н. В. Общая химия / Н. В. Коровин. – 12-е изд., – М. : Высшая школа, 2010. - 557 с.: с ил. 2. http://www.chem.msu.su/rus/school/zhukov ОГЛАВЛЕНИЕ
Введение…………………...………………………………………3 1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ……………………………3 1.1. Комплексы ……………………………………………………3 1.2. Комплексообразователи……………………………………..5 1.3. Лиганды……………………………………………………….5 2. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ…….5 3. ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИХ И ИХ СТРОЕНИЕ……………………………………………………8 4 ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ………11 5 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ……………………………14 6 ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ……………………………..17
Литература…………………………………………………………18 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|