
|
|
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИХ И ИХ СТРОЕНИЕ12 Кафедра «Моделирование систем и информационные технологии»
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Методические указания к лабораторным работам по курсу «ХИМИЯ»
СОСТАВИТЕЛИ: БЕЛОВА С.Б ГРИШИНА Н.Д. БЕЛОВ С.П.
МОСКВА 2011
Комплексные соединения. Методические указания к лабораторным работам по курсу «Химия»/ сост. С.Б.Белова, Н.Д.Гришина, С. П. Белов ─ М.: МАТИ, 2011 ─ 20 с.
© Белова С.Б., Гришина Н.Д., Белов С.П., составление, 2011 © МАТИ, 2011 ВВЕДЕНИЕ Комплексные соединения широко распространены в природе. Они играют большую роль в жизнедеятельности организмов; например, гемоглобин, хлорофилл являются комплексными соединениями. Комплексные соединения применяются в химическом анализе, в технологии при получении ряда металлов (золота, серебра, металлов платиновой группы и др.), для разделения смесей элементов, например, лантаноидов. Огромная область применения комплексов переходных металлов — каталитические процессы. Целью данной работы является изучение строения комплексных соединений и их химических свойств.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Комплексы Комплексные ( или координационные) соединения – сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму. Эти соединения имеют в своем составе устойчивые группы, называемые комплексами, которые переходят без изменений из одного соединения в другое и сохраняются при растворении соединений. Согласно координационной теории швейцарского ученого А. Вернера комплексные соединения состоят из 2-х сфер: – внешней и – внутренней. Внутренняя сфера, называемая также комплексом, включает: – центральный ион (Cd2+, Fe3+) или атом – комплексообразователь – вокруг центрального иона или атома координируются отрицательно заряженные ионы (CN) или нейтральные молекулы (NH3). Ионы или молекулы, координируемые комплексообразовате-лем, называютлигандами. При записи комплексного соединения внутреннюю сферу или комплекс заключают в квадратные скобки. Координационное число – число лигандов, координируемых комплексообразователем ( 4 и 6 соответственно). В зависимости от заряда различают комплексы: - анионные ([Pb F6] 2-) -катионные ([Cd(NH3)4] 2+) -нейтральные ( [Ni(CO)4]). Нейтральные комплексы не имеют внешней сферы. Заряд комплекса равен алгебраической сумме заряда центрального иона и зарядов лигандов. Комплексообразователи Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической системы элементов. Лиганды К числу лигандов относятся -простые анионы (например, F-, Cl-, Br-, I-., S2-); -сложные анионы (например, CN-,NCS-, NO3-); -молекулы (например, Н2О, NH3). Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В названиях комплексных соединений первыми приводят анион, а затем катион. В названии комплексного иона на первом месте записывается комплексообразователь, а за ним – лиганды. Число лигандов отмечается цифрой в нижнем индексе. Формулу комплексного иона (внутренняя сфера) заключают в квадратные скобки, и тогда заряд комплексного иона записывается в верхнем индексе за скобками. K4[Fe(CN)6] – гексацианоферрат (II) калия. Названия наиболее распространенных лигандов:
В формуле комплексной соли (или соединения) частицы внешней сферы записывают перед скобками, если ионы имеют положительный заряд (катионы), и после скобок, если их заряд отрицателен (анионы). Числа ионов внешней сферы отмечаются нижним индексом при формуле иона. Например: K4[Fe(CN)6] – гексацианоферрат(II) калия, [Cu(NH3)4]Cl2 – дихлорид тетраамминмеди(II). Формула комплексного соединения читается в обратной последовательности ее написания, т.е. справа налево. Если комплексный ион является катионом и после квадратных скобок записаны анионы, то сначала дают их название в именительном падеже, а затем (в записи словами делается промежуток) переходят к числу лигандов и их названию и наконец говорят о комплексообразователе в родительном падеже с указанием римской цифрой в круглых скобках его заряда. Например: [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди(II), Примеры названий комплексных катионов:
Если комплексный ион является анионом и катионы внешней сферы записаны перед квадратными скобками, то название начинается с числа лигандов, затем указываются лиганды, далее комплексообразователь с его зарядом и наконец катионы внешней сферы в родительном падеже. Например: K4[Fe(CN)6] – гексацианоферрат(II) калия. Примеры названий комплексных анионов: [Zn(OH)4]2- – тетрагидроксоцинкат-ион [Ag(S2O3)2]3- – ди(тиосульфато)аргентат(I)-ион [Cr(CN)6]3- – гексацианохромат(III)-ион [Al(H2O)2(OH)4] - – тетрагидроксодиакваалюминат-ион [Co(NH3)2(NO2)4] - – тетранитродиамминкобальтат(III)-ион [Fe(H2O)(CN)5]3- – пентацианоакваферрат(II)-ион Примеры названий нейтральных комплексных частиц:
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИХ И ИХ СТРОЕНИЕ В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами – ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная. В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы подонорно-акцепторному механизму. В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью. Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции: FeCl2кр + 6H2O = [Fe(H2O)6]2+ + 2Cl_ Электронная формула атома железа – 1s22s22p63s23p64s23d6. Составим схему валентных подуровней этого атома:
При образовании двухзарядного иона атом железа теряет два 4s-электрона:
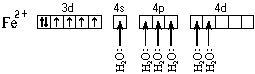
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:
Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:
Пространственное строение этой частицы выражается одной из пространственных формул:
Форма координационного полиэдра – октаэдр. Все связи Fe-O одинаковые. Предполагается sp3d2-гибридизация АО атома железа. Магнитные свойства комплекса указывают на наличие неспаренных электронов. Если FeCl2 вводить в раствор, содержащий цианид-ионы, то протекает реакция FeCl2кр + 6CN Тот же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN: [Fe(H2O)6]2+ + 6CN- = [Fe(CN)6]4- + 6H2O . Это говорит о том, что цианидный комплекс прочнее аквакомплекса. В цианидном комплексе отсутствуют неспаренные электроны у атома железа. Все это связано с несколько иным электронным строением этого комплекса:
Более «сильные» лиганды CN "Сила" лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их «силы» (своеобразный «ряд активности» лигандов), который называется спектрохимическим рядом лигандов:
Для комплексов [Fe(H2O)6]3
Для комплексов с координационным числом = 4 возможны две структуры: тетраэдр (в случае sp3-гибридизации), например, [Zn(H2O)4]2+, и плоский квадрат (в случае dsp2-гибридизации), например, [Cu(NH3)4]2+. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|




 = [Fe(CN)6]4
= [Fe(CN)6]4 
 образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы «нарушить» правило Хунда и освободить 3d-орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d2sp3.
образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы «нарушить» правило Хунда и освободить 3d-орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d2sp3.
