
|
|
Лабораторная работа «Йодометрическое определение содержания меди»
Определение основано на восстановление меди (2+) до меди (1+) йодидом калия. Однако эта реакция протекает медленно, и прямое титрование невозможно. Поэтому к раствору соли Cu2+ добавляют избыток KJ. В результате выделяется йод в количестве, эквивалентном содержанию меди. Полученный йод оттитровывают раствором тиосульфата натрия. Протекающие в ходе анализа реакции можно отобразить следующими уравнениями: 2CuSO4(p-p) + 4KJ(тв) Û Cu2J2(тв) + K2SO4(p-p) + J2(p-p) (2.12) В ходе реакции образуются белый осадок йодида меди (I) и бурый раствор йода. Реакция протекает в течение 3-5 минут, лучше в темноте. Выделившийся йод титруют раствором тиосульфата натрия по реакции: 2Na2S2O3 + J2 Û 2NaJ + Na2S4O6; (2.13) Суммарную реакцию можно отобразить уравнением: 2Сu2+ + 2S2O32- Û 2Cu+ + S4O62-; (2.14) Тиосульфат расходуется при титровании в количестве, эквивалентном содержанию меди в пробе, согласно реакции (2.14), хотя непосредственно данная реакция не протекает. Из раствора пробы отбирают пипеткой в конические колбы для титрования не менее 2-х аликвот объемом по 5 мл, добавляют 10-15 капель 2 н. раствора серной кислоты и разбавляют дистиллированной водой до 20-30 мл. Затем в колбы с помощью шпателя добавляют избыток сухого йодида калия и оставляют колбы на 5 минут в темноте при периодическом перемешивании для полного протекания реакции. В это время готовят бюретку для титрования. По окончании реакции выделившийся йод оттитровывают раствором тиосульфата натрия. Эквивалентную точку определяют по обесцвечиванию крахмала, который добавляют в количестве 5-6 капель в качестве индикатора на йод. Расчет результатов ведут по формуле (2.2). Для перевода полученной нормальной концентрации в г/л, результат домножают на электрохимический эквивалент меди, равный её молярной массе. Лабораторная работа «Определение содержания кальция и магния в совместном присутствии»
Задача определения содержания кальция и магния при их совместном присутствии в растворе возникает при определении жесткости воды. Её решают трилонометрическим методом. Поскольку при реакции трилона с катионами металлов выделяются катионы Н+, титрование ведут в среде аммиачно-хлоридного буфера (смеси растворов NH4OH и NH4Cl). Полученный эквивалентный объем трилона V1 отвечает суммарному содержанию кальция и магния. Затем титрование повторяют в сильнощелочной среде, при рН = 13-14. При этом магний выпадает в осадок в виде гидроксида. Эквивалентный объем V2 отвечает содержанию в пробе только кальция. Содержанию магния соответствует разность полученных эквивалентных объемов DV = V1 – V2. Для титрования из раствора пробы отбирают пипеткой в конические колбы 2 аликвоты объемом 5 мл. К аликвотам добавляют по 5 мл аммиачно-хлоридного буфера и дистиллированную воду до объема 20-30 мл. Затем вносят в колбы немного сухого индикатора «эриохром черный» и титруют из бюретки раствором трилона Б до перехода красной окраски в синюю. Записывают эквивалентный объем V1. Затем приступают ко второй части работы. Вновь из раствора пробы отбирают в конические колбы 2 аликвоты по 5 мл, добавляют к ним по 5 мл раствора щелочи с концентрацией 1 н. и перемешивают. Затем вносят в колбы немного сухого индикатора «мурексид» и титруют трилоном до перехода окраски от розовой к сиреневой. Записывают эквивалентный объем трилона V2. Результаты рассчитывают по формулам:
Для перевода полученных молярных концентраций в г/л их надо домножить на молярные массы элементов. Лабораторная работа «Определение содержания цветных металлов трилонометрическим методом»
В работе определяют концентрации меди (2+), никеля и цинка в раздельных пробах. Из выданных для анализа растворов отбирают мерной пипеткой в конические колбы по 2 аликвоты объемом 5 мл. Затем создают необходимую для титрования среду, добавляют дистиллированную воду до объема 20-30 мл, немного сухого индикатора и титруют раствором трилона Б. Медь и никель титруют в аммиачной среде (аммиак добавляют к аликвотам по каплям при перемешивании до растворения образующейся от первых капель основной соли) с индикатором «мурексид». Переход окраски индикатора в эквивалентной точке от желтой к сиренево-фиолетовой. Цинк титруют в среде аммиачно-хлоридного буфера, который добавляют к аликвотам с помощью мерного цилиндра в количестве 5 мл. Эквивалентную точку определяют по переходу окраски индикатора «эриохром черный» от красной к синей. Результаты рассчитывают по формуле (2.2). Полученные молярные концентрации переводят в г/л путем домножения их на молярные массы элементов. Задачи для решения.
2.1.Из аликвотной части объемом 50 мл раствора сульфата алюминия осадили сульфат-ион в виде сульфата бария. Вес сухого осадка равен 0,2640 г. Вычислить концентрацию в г/л и в моль/л сульфат-ионов и сульфата алюминия. Ответ: 2,173 г/л SO42-. 2.2. Из навески чугунных стружек массой 2,851 г, после соответствующей обработки, получили 0,0824 г диоксида кремния. Вычислить процентное содержание кремния в чугуне. Ответ: 1,35 %. 2.3.При анализе навески апатита массой 0,1112 г получили 0,9926 г сухого осадка (NH4)3PO4×12MoO3. Вычислить процентное содержание Р2О5 в апатите. Ответ: 33,78 %. 2.4.Из навески известняка массой 0,5210 г, после растворения её, соответствующих осаждений и прокаливания, получили 0,2218 г СаО и 0,0146 г Mg2P2O7. Вычислить процентное содержание карбонатов кальция и магния в известняке. Ответ: 75,98 и 2,12 %. 2.5.Из навески 0,8325 г латуни, состоящей из меди, олова и цинка, при анализе было получено 0,6728 г CuCNS и 0,0423 г SnO2. Вычислить процентный состав латуни. Ответ: 42,23 % Cu, 4,00 % Sn, 53,77 % Zn. 2.6.В навеске 0,1341 г сильвинита определяли содержание калия осаждением его в форме KСlO4. Вес сухого осадка равен 0,2206 г. Вычислить процентное содержание хлорида калия в сильвините. Ответ: 88,52 %. 2.7.При анализе сурьмяного блеска Sb2S3 была взята навеска массой 0,1872 г. Вся сера была переведена в сульфат-ион, который осадили в виде BaSO4, масса которого оказалась равной 0,3243 г. Вычислить процентное содержание Sb2S3 в руде. Ответ: 84,04 %. 2.8.При анализе навески 0,4620 г пирита получили 1,774 г сульфата бария. При параллельном анализе второй навески 0,4224 г получили 1,617 г сульфата бария. Каково среднее содержание серы в пирите? Ответ: 52,66 %. 2.9.Навеску цемента массой 1,861 г растворили и осадили кальций. Из 250 мл полученного фильтрата отобрали аликвоту объемом 100 мл и осадили MgNH4PO4. После прокаливания получили весовую форму Mg2P2O7, масса которой была равна 0,2516 г. Вычислить процентное содержание оксида магния в цементе. Ответ: 12,24 %. 2.10.При определении содержания оксида алюминия в железной руде осаждением AlPO4 вместе с алюминием осаждаются фосфаты титана Ti2P2O9 и циркония ZrP2O7. Вычислить процентное содержание оксида алюминия в руде, если из навески руды массой 0,2430 г получили осадок фосфатов алюминия, титана и циркония общей массой 0,2512 г, а при дальнейшем анализе руды в ней было найдено 2,40 % титана и 0,050 % циркония. Ответ: 38,58 %. 2.11.При анализе навески фосфорита массой 0,2140 г получено 0,1536 г Mg2P2O7. Вычислить процентное содержание Р2О5 в фосфорите. Ответ: 45,75 %. 2.12.Навеску стали массой 1,086 г растворили и осадили диметилглиоксимат никеля. Масса высушенного осадка составила 0,2136 г. Вычислить процентное содержание никеля в стали. Ответ: 4,00 %. 2.13.Какова молярная концентрация серной кислоты, если на титрование 0,4519 г буры Na2B2O7×10H2O израсходовали 16,43 мл этого раствора. Ответ: 0,0721 М. 2.14.Из 6,227 г буры Na2B2O7×10H2O приготовили 250 мл раствора. На титрование аликвоты 25 мл этого раствора израсходовали 24,17 мл соляной кислоты. Определить нормальную концентрацию растворов буры и соляной кислоты. Ответ: 0,1306 и 0,1352 н. 2.15.20 мл 0,2215 н. раствора соляной кислоты требуют для нейтрализации 21,40 мл раствора Ва(ОН)2, а 25 мл уксусной кислоты нейтрализуются 22,55 мл того же раствора. Вычислить нормальную концентрацию уксусной кислоты. Ответ: 0,1867 н. 2.16.Рассчитать процентное содержание карбоната натрия в растворе с плотностью 1,05 г/см3, если на титрование аликвоты 20 мл по метиловому оранжевому израсходовали 33,45 мл 0,57 н. раствора соляной кислоты. Ответ: 4,82 %. 2.17.Рассчитать концентрацию серной кислоты в г/л, если на титрование аликвоты 10 мл израсходовали 20,60 мл 1,01 н. раствора едкого натра. Ответ: 101,95 г/л. 2.18.Навеску массой 0,5 г смеси карбонатов натрия и калия растворили в мерной колбе на 100 мл. На нейтрализацию аликвоты объемом 10 мл по метиловому оранжевому израсходовали 3,95 мл 0,2 н. раствора соляной кислоты. Вычислить процентное содержание карбоната натрия в смеси. Ответ: 30,3 %. 2.19.Навеску массой 4,0 г нитрата аммония растворили в мерной колбе на 500 мл. К аликвоте 25 мл добавили 10 мл раствора формалина. На титрование азотной кислоты, выделившейся при взаимодействии нитрата аммония с формалином, израсходовали 24,25 мл 0,1 н. раствора едкого натра. Влажность нитрата аммония 2,2 %. Вычислить процентное содержание NH4NO3 и азота в нитрате аммония в пересчете на сухое вещество. Ответ: 99,3 и 34,75 %. 2.20.На титрование аликвоты ортофосфорной кислоты объемом 10 мл израсходовали 8,2 мл 0,1 н. раствора щелочи. Вычислить молярную концентрацию кислоты в пробе, если титрование вели до перехода окраски фенолфталеина из бесцветной в малиновую. Ответ: 0,041 М. 2.21. На титрование аликвоты серной кислоты объемом 10 мл израсходовали 13,4 мл 0,1 н. раствора щелочи. Вычислить молярную концентрацию кислоты. Ответ: 0,067 М. 2.22. На титрование аликвоты гидроксида бария объемом 10 мл израсходовали 24,6 мл 0,1 н. раствора соляной кислоты. Вычислить молярную концентрацию Ba(OH)2. Ответ: 0,123 М. 2.23. На титрование аликвоты раствора карбоната натрия объемом 10 мл израсходовали 14,2 мл 0,1 н. раствора серной кислоты. Вычислить нормальную и молярную концетрации карбоната натрия, если титрование вели до обесцвечивания розовой окраски фенолфталеина. Ответ: 0,284 н., 0,142 М. 2.24. На титрование аликвоты раствора сульфата никеля (П) объемом 10 мл израсходовали 12,4 мл 0,05 М раствора трилона Б. Вычислить нормальную концентрацию сульфата никеля. Ответ: 0,124 н. 2.25. Сколько миллилитров раствора трилона Б с концентрацией 0,05 М будет израсходовано на титрование аликвоты объемом 10 мл раствора с концентрацией по сульфату цинка 0,14 н. и по хлориду меди (П) 0,08 М? Ответ: 30 мл.
ОГЛАВЛЕНИЕ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ............................................................................................................................. 1 1. ВЕСОВОЙ АНАЛИЗ......................................................................................................................................... 1 1.1. Введение....................................................................................................................................................... 1 1.2. Лабораторная работа «Определение содержания железа весовым методом»....................... 3 2. ОБЪЕМНЫЙ АНАЛИЗ..................................................................................................................................... 4 2.1. Введение....................................................................................................................................................... 4 2.2. Кислотно-основное титрование............................................................................................................ 5 2.3. Окислительно-восстановительное титрование.............................................................................. 14 2.4. Комплексонометрия............................................................................................................................... 15 2.5. Лабораторная работа «Определение содержания соды в присутствии щелочи»............... 16 2.6. Лабораторная работа «Перманганатометрическое определение содержания железа (2+)» 17 2.7. Лабораторная работа «Йодометрическое определение содержания меди»......................... 18 2.8. Лабораторная работа «Определение содержания кальция и магния в совместном присутствии» 19 2.9. Лабораторная работа «Определение содержания цветных металлов трилонометрическим методом» 20 3. Задачи для решения....................................................................................................................................... 20

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 , моль/л
, моль/л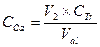 , моль/л.
, моль/л.