|
|
Кислотно-основное титрованиеАналитическая реакция – нейтрализация кислоты щелочью или, наоборот, щелочи кислотой. Расчет результатов ведут по уравнению, вытекающему из (2.1):
Эквивалентную точку определяют обычно с помощью цветных индикаторов. Индикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой -SO3H. Процесс их диссоциации в общем виде можно представить уравнением:
Константа диссоциации индикатора равна:
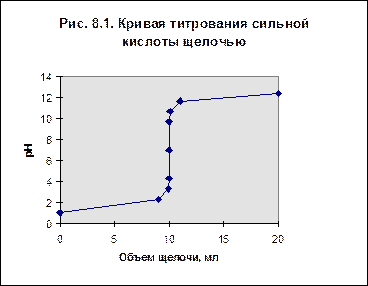
Концентрации ионной и молекулярной форм в середине области перехода окраски индикатора равны между собой и рНпер= рKd. При Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к желтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области, при рН около 7. Так как индикатор должен изменять окраску в эквивалентной точке, для правильного его выбора необходимо знать зависимость рН от объема добавленного в ходе анализа титранта. Эти зависимости называют кривыми титрования. Кривая титрования сильной кислоты щелочью Возьмем аликвоту раствора сильной кислоты объемом 10 мл (0,01 л) и будем титровать её 0,1 н. раствором щелочи. Концентрацию кислоты в примере выберем 0,1 н. В таблице приведены рассчитанные значения рН в ходе титрования. Зависимость рН от объема добавленного титранта дана на рис. 1. Таблица 1. Данные для построения кривой титрования
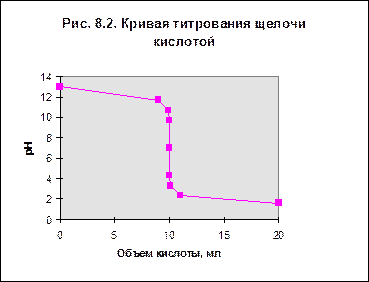
Точка эквивалентности соответствует объему титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объем одной капли раствора обычно составляет не менее 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щелочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно засечь с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10. Кривая титрования щелочи кислотой будет зеркальным отражением построенной зависимости.
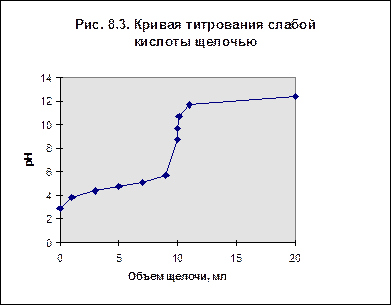
Кривая титрования слабой кислоты щелочью Для титрования возьмем в качестве примера аликвоту объемом 10 мл 0,1 М раствора уксусной кислоты и будем титровать её 0,1 М раствором щелочи. Результаты расчета кривой титрования приведены в табл. 2. Таблица 2. Данные для построения кривой титрования
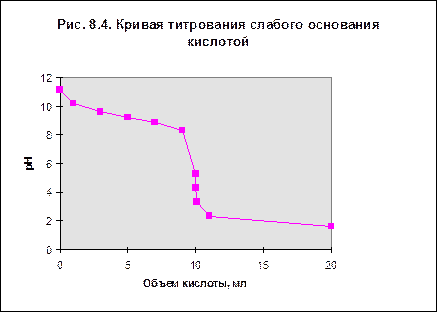
При рассмотрении кривой титрования обращает внимание то, что точка эквивалентности лежит в щелочной области. Скачок значений рН вблизи эквивалентной точки меньше, чем на рис.1, не превышает 1-2-х единиц при добавлении одной капли титранта. Для титрования следует выбирать индикатор, изменяющий окраску в щелочной среде, в примере - при рН=9-10. Таковым является фенолфталеин. Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного - амина, будет зеркальным отображением графика 3. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-5. Таковым является метиловый оранжевый.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
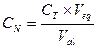 , экв/л. (2.2)
, экв/л. (2.2)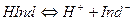
 (2.3)
(2.3) цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при
цвет раствора будет обусловлен окраской ионной формы индикатора и, наоборот, при  раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области рН = pKd ± 1.
раствор будет окрашен молекулярной формой индикатора. Поэтому переход окраски происходит в области рН = pKd ± 1.