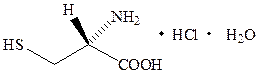|
|
Лабораторно-практическое занятие № 2
Фармацевтический анализ лекарственных средств группы аминокислот алифатического ряда
Цель: Освоить методы контроля качества лекарственных средств группы аминокислот алифатического ряда и их производных по показателям «описание», «подлинность», «чистота», «содержание действующего вещества». Структура занятия: 1. Семинар - 90 мин 2. Контрольный тест - 15 мин 3. Лабораторная работа – 45 мин 4. Защита лабораторной работы – 30 мин. Аминокислоты представляют собой производные карбоновых кислот, содержащие в молекуле одну или несколько аминогрупп. a - Аминокислоты являются структурными элементами белков и широко распространены в природе. Аминокислоты являются амфотерными соединениями и способны образовывать внутренние соли в виде биполярного иона (цвиттер-иона):
Их оснóвные свойства обусловлены присутствием NН2-группы, а кислотные – СООН-группы:
Общегрупповыми реакциями являются: 1) Реакция образования комплексной соли меди(II):
темно-синий
Это координационное соединение мало растворимо в воде, что позволяет выделять аминокислоты из смеси с другими веществами. 2) Нингидриновая реакция является одной из старейших (1910), но широко применяемых и до сих пор, цветных реакций на a-аминокислоты (Н.А.Тюкавкина, 2008). Тем не менее природа всех образующихся окрашенных продуктов до сих пор окончательно не установлена. Упрощённо схема реакции может быть представлена следующим образом:
Продукт нингидриновой реакции имеет сине-фиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое сорбента), а также спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм). Эта реакция неспецифична, так как окрашенные продукты с нингидрином дают b-аминокислоты, аммиак, первичные и вторичные амины, мочевина, белки и ряд других соединений, содержащих аминогруппу. Программа по дисциплине «Фармацевтическая химия» включает следующие ЛС: кислота глутаминовая, , цистеин, ацетилцистеин, метионин, пеницилламин; натрия кальция эдетат (кальций-динатриевая соль этилендиаминтетрауксусной кислоты, тетацин-кальций); пирацетам (Ноотропил) как аналог гамма-аминомасляной кислоты; кислота g-аминомасляная (Аминалон); производные пролина: каптоприл, эналаприл; кислота аминокапроновая; мелфалан – производное фенилаланина.
Кислота глутаминовая (Acidum glutaminicum)
(S)-2-аминопентан-1,5-диовая кислота
С5Н9NО4 Мr 147,1
Глутаминовая кислота относится к фармакологической группе психостимуляторы и ноотропы. Применяется при лечении заболеваний центральной нервной системы: эпилепсии, психозов, реактивных состояний, протекающих с явлениями истощения, депрессии.
Описание. Глутаминовая кислота представляет собой белый кристаллический порошок, легко растворимый в горячей воде, мало растворимый в холодной воде, практически нерастворимый в уксусной кислоте, ацетоне и спирте.
Определение подлинности проводят физическими, физико-химическими и химическими методами: Методом поляриметрии определяют удельное вращение 10% раствора глутаминовой кислоты в разведенной HCl: [α] ИК-спектр субстанции, полученный методом прессования с KBr, по интенсивностям и частотам полос должен быть идентичен спектру стандартного образца кислоты глутаминовой. Метод ТСХ: пятно на хроматограмме, полученное для субстанции, должно быть идентично по положению, цвету и размеру пятну, полученному для стандартного образца глутаминовой кислоты. Для проявления пятен хроматограммы опрыскивают раствором нингидрина. Один из методов определения подлинности кислоты глутаминовой заключается в следующем: к 2 мл 10% раствора глутаминовой кислоты в 1 моль/л HCl добавляют 0,1 мл фенолфталеина (раствор остается бесцветным). При добавлении 3,0 мл того же раствора глутаминовой кислоты к 3,5 мл раствора 1 моль/л NaOH в присутствии фенолфталеина появляется красное окрашивание. К нему добавляют смесь, состоящую из 3 мл раствора формальдегида и 3 мл дистиллированной воды. Красная окраска постепенно переходит в розовую, а затем совсем исчезает. Наблюдаемые явления объясняются следующим образом. Поскольку аминокислота – амфотерное соединение, добавление щелочи к ее раствору не приводит к полной нейтрализации раствора (нейтрализуется только одна из двух карбоксильных групп):
Окраска раствора остается красной (щелочь не полностью нейтрализована). При добавлении раствора формальдегида протекает реакция Серенсена:
При блокировании аминогруппы глутаминовой кислоты увеличиваются ее кислотные свойства. Это приводит к полной нейтрализации щелочи за счет протекания реакции со второй карбоксильной группой:
При этом окраска раствора исчезает полностью. Оценка чистоты.Раствор кислоты глутаминовой (10%) в 1 моль/л растворе HCl должен быть прозрачным и бесцветным. Родственные примеси, дающие положительную нингидриновую реакцию определяют методом ТСХ. Допустимыми примесями являются: хлориды, сульфаты, ионы аммония, железа, тяжелые металлы. Кроме того, определяют потерю в массе при высушивании и сульфатную золу.
Количественное определение проводят методом нейтрализации. Глутаминовую кислоту титруют 0,1 моль/л раствором гидроксида натрия. Индикатор - бромтимоловый синий. В точке эквивалентности, соответствующей моменту нейтрализации одной карбоксильной группы, наблюдается переход окраски из желтой в голубую. 1 мл 0,1 моль/л раствора NaOH соответствует 14,71 мг С5Н9NО4.
Метионин (Methioninum)
(S)-2-амино-4-(метилтио)бутановая кислота
C5H11NO2S Мr 149,2
Метионин относится к фармакологической группе: белки и аминокислоты, гепатопротектры. Применяют при заболеваниях печени (цирроз, алкогольная гепатопатия, токсический гепатит), а также для лечения дистрофии, возникающей в результате белковой недостаточности. Описание. Метионин представляет собой белый или почти белый кристаллический порошок или бесцветные кристаллы. Растворим в воде, очень легко растворим в спирте, практически нерастворим в эфире.
Определение подлинности проводят методом поляриметрии: удельное вращение 2% раствора метионина в хлороводородной кислоте [α] ИК-спектр метионина должен соответствовать спектру стандартного образца метионина:
Методом хроматографии в тонком слое (ТСХ) анализируют подлинность и чистоту ЛС. Полученную хроматограмму проявляют раствором нингидрина. Оценка чистоты.Водный раствор метионина (2,5%) должен быть прозрачным и бесцветным и иметь рН от 5,5 до 6,5. В субстанции метионина допустимыми примесями являются: хлориды, сульфаты, ионы аммония, железа, тяжёлых металлов. Потеря в массе при высушивании - не более 0,5%.
Количественное определение проводят методом неводного титрования. Субстанцию растворяют в ледяной уксусной кислоте. Титрант – 0,1 моль/л HСlO4. Точку эквивалентности определяют потенциометрически. 1 мл 0,1 моль/л раствор HСlO4 эквивалентен 14,92 мг метионина.
Цистеина гидрохлорид (Cysteini hydrochloridum)
(R)-2-амино-3-меркаптопропановой кислоты гидрохлорид C3H7NO2S×HCl×H2O Mr 175,6
Цистеин относится к фармакологической группе: белки и аминокислоты. Цистеин участвует в обмене веществ хрусталика глаза, а изменения, происходящие при катаракте, обусловлены нарушением содержания в нём данной аминокислоты. По этой причине предложено применять цистеин для задержки развития катаракты. Описание.Белый кристаллический порошок, легко растворимый в воде, мало растворим в спирте, практически нерастворим в эфире. Определение подлинности проводят физическими, физико-химическими и химическими методами: Методом поляриметрии определяют удельное вращение 8% раствора цистеина гидрохлорида в разведенной хлороводородной кислоте: [α] ИК-спектр субстанции, полученный методом прессования с KBr, по интенсивностям и частотам полос должен быть идентичен спектру стандартного образца цистеина гидрохлорида. При использовании хроматографии в тонком слое основное пятно на хроматограмме, должно быть идентично по положению, цвету и размеру пятну, полученному для стандартного образца цистеина гидрохлорида. В качестве проявителя используют раствор нингидрина. При добавлении к щелочному раствору субстанции раствора натрия нитропруссида появляется интенсивное фиолетовое окрашивание, переходящее сначала в красно-коричневое, а затем в оранжевое. Окраска обусловлена формированием координационных соединений разного состава. При добавлении хлороводородной кислоты окрашивание переходит в зелёное. Хлорид-ионы обнаруживают по реакции с раствором серебра нитрата.
Оценка чистоты. Родственные примеси, дающее положительную нингидриновую реакцию, определяют методом ТСХ. Допустимыми примесями являются: сульфаты, ионы аммония и железа, тяжелые металлы, также определяют потерю в массе при высушивании и сульфатную золу. Количественное определениепроводят методом обратного йодометрического титрования. Субстанцию цистеина гидрохлорида растворяют в воде, добавляют калия йодид, хлороводородную кислоту и избыток раствора йода. Смесь оставляют в темноте на 20 минут.
Избыток йода оттитровывают стандартным раствором тиосульфата натрия.
В качестве индикатора используют крахмал, который добавляют в конце титрования. 1 мл 0,05 моль/л раствора йода соответствует 15,76 мгC3H8ClNO2S.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|





 от +30,5 до +32,5о.
от +30,5 до +32,5о.