
|
|
Стереохимическая номенклатураСтереохимическая номенклатура 4 2.2.3. Проекционные формулы Фишера 5 2.2.4. σ-Диастереоизомерия 6 А. Мезо-соединения 7 2.2.5. p-Диастереомеры 8 2.3. Способы получения алканов 9 2.3.1. Гидрирование ненасыщенных углеводородов 9 2.3.2. Декарбоксилирование карбоновых кислот (Дюма) 10 2.3.3. Восстановление алкилгалогенидов 11 2.3.4. Электролиз солей карбоновых кислот 11 2.3.5. Сочетание галогенуглеводородов (реакция Вюрца) 11 2.4. Реакции алканов 12 2.4.1. Галогенирование 13 А. Хлорирование метана 13 Б. Хлорирование гомологов метана 14 В. Реакции алканов с другими галогнами 15 2.4.2. Сульфохлорирование 15 2.4.3. Действие высокой температуры 16 2.4.4. Окисление 17
Углеводороды
Соединения, состоящие из атомов лишь двух элементов - углерода и водорода называют углеводородами. Углеводороды, в молекулах которых углеродные атомы образуют открытые, незамкнутые цепи, называют ациклическими углеводородами или углеводородами жирного ряда. Их подразделяют на два класса: предельные, или насыщенные, углеводороды и непредельные, или ненасыщенные, углеводороды. Насыщенные углеводороды с открытой цепью и содержащие лишь одинарные (простые) углерод-углеродные связи называют алканами. Алканы с открытой неразветвленной цепью называют нормальными алканами (н-алканы). Алканы относятся к алифатическим углеводородам, т. к. свойства высших алканов напоминают свойства жиров и масел. Первые четыре алкана называют: метан, этан, пропан и бутан. Названия последующих членов ряда строятся из корня (главным образом греческие числительные) и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22, ундекан С11Н24, додекан С12Н26, и т. д.
2.2. Хиральность. Энантиомерия.
Для изображения пространственных взаимоотношений в молекуле или ее части на бумаге служат стереохимические формулы. В них связи, выходящие вперед из плоскости бумаги, изображаются жирной чертой или заштрихованным клином, а связи, уходящие под плоскость бумаги - пунктирной линией. Обычная валентная черта символизирует связь, лежащую в плоскости бумаги. Если же точное пространственное направление связи не определено, то используют волнистую линию.
Если вы сравните свои левую и правую руки, вы обнаружите, что они представляют собой зеркальное изображение одна другой. Хотя обе руки состоят из одинакового количества совершенно одинаковых пальцев, они отличаются по конфигурации.
2.2.1. Энантиомерия.
В молекуле CHClBrI вокруг атома углерода расположены различные атомы. Такая молекула может существовать в виде двух изомеров, относящихся друг к другу как предмет и его отражение в зеркале. Такие изомеры называют зеркальными. Замечательная особенность зеркальных изомеров заключается в том, что они обладают одинаковыми химическими и физическими свойствами. И все же есть один способ, позволяющий различить эти вещества. Если пропустить через растворы двух стереоизомеров плоско поляризованный свет (это значит, что электрический вектор светового электромагнитного поля колеблется в одной плоскости), то в одном случае плоскость поляризации повернется влево, а в другом случае - на такой же угол вправо. Поэтому такие изомеры называются еще оптическими, а также энантиомерами (по-гречески “энантиос” значит “противоположный”). Молекулы одинакового строения, но с разным расположением атомов в пространстве называют конфигурационными или стереоизомерами. Простейшим примером конфигурационных изомеров являются две молекулы CHClBrI с различным расположением атомов вокруг атома углерода:
(R)-бромиодхлорметан (S)-бромиодхлорметан
Такой атом углерода является стереоцентром. Если смотреть на атомы углерода (стереоцентры) этих молекул в сторону наиболее легкого атома (водорода) как это показано стрелкой, и перечислять атомы галогенов в порядке уменьшения их атомных номеров (атомных масс), то мы увидим, что в левой молекуле это перечисление происходит по часовой стрелке, а в правой – против. Изомер с перечислением заместителей по часовой стрелке называют R-изомером, а против часовой стрелке – S-изомером. Удобнее изображать стереоизомеры с наиболее легким атомом за плоскостью чертежа:
(S)-бромиодхлорметан (R)-бромиодхлорметан
Способность молекул, да и других объектов, существовать в виде самостоятельных зеркально симметричных форм называется “хиральностью”, от греческого “хейр” - рука. Вместо слова “хиральность” можно использовать слово “рукоподобие”. Хиральностью называют свойство объекта быть несовместимым со своим зеркальным изображением. Для того чтобы молекула была хиральна (рукоподобна), она должна отличаться от своего зеркального отражения. Хиральная молекула не совместима со своим зеркальным изображением.
Стереохимическая номенклатура
В основе номенклатуры стереоизомеров лежит система Кана-Ингольда-Прелога. Для называния стереоизомера сначала нумеруют четыре группы, связанные с хиральным углеродом (стереоцентром) от наиболее приоритетного (старшего) до наименее приоритетного (младшего) в соответствии с правилом приоритетности (старшинства). Согласно этому правилу атом с большим атомным номером является приоритетным (старшим).
Атомный номер (1) (6) (7) (8) (16) (17) (35) (58) -Н, -СН3, -NН2, -OH, -SH, -Cl, -Br, -I
Большинство стереоцентров связанны с двумя атомами углерода. В таком случае для определения их старшинства необходимо учитывать приоритенсть заместителей у этих атомов. Наиболее приоритетными из них будет тот, который связанн с более приоритетным заместителем. Хиральной является, например, молекула 2-бромбутана. Атом С-2 в ней яявляется стереоцентром, поскольку он связан с четырьмя разными заместителями. В 2-бромбутане наиболее приоритетным (старшим) заместителем является атом брома (1), затем идут атомы углерода этильной (2) и метильной (3) групп. Наименее приоритетным (самым младшим) заместителем (4) является атом водорода. После того как определено старшинство заместителей, молекулу рассматривают со стороны, противоположной наименее приоритетному атому (4). Глядя на молекулу с этой стороны, проводят окружность от группы (1) к группе (2) и затем к группе (3). Если обход 1-2-3 совершается по часовой стрелке, то молекулу обозначают (R), если же - против часовой стрелки, то ее обозначают (S).
(2S)-2-бромбутан (2R)-2-бромбутан
При определении приоритетности заместителей, содержащих двойные связи, их рассматривают как дважды соединенными с соответствующим атомом. Например, карбоксильная группа
Если образец соединения содержит равные количества двух энантиомеров, мы говорим, что это рацемическая смесь. Рацемическая смесь не вращает плоскость поляризованного света, поскольку луч поляризованного света, проходя через такой раствор, встретит равные количества право- и левовращающих молекул. Физические свойства рацемической смеси не обязательно идентичны свойствам чистого энантиомера; в частности, температура плавления рацемической смеси обычно отличается от температуры плавления энантиомера. Это связано с тем, что смесь лево - и правооринтированных объектов обычно упаковывается вместе в кристалле не так, как это делает только правоориентированный или только левоориентированный объект. Процесс превращения одного из двух энантиомеров в рацемическую форму называют рацемизацией. Под расщеплением рацемической формы понимают выделение из нее энантиомеров. Перевод одного энантиомера в другой называется инверсией. Поскольку физические свойства энантиомеров одинаковы, их чрезвычайно трудно разделить. Известно несколько методов расщепления. Впервые расщепление было осуществлено в 1848 г. Луи Пастером. Изучая кристаллы соли рацемической винной кислоты, Пастер обратил внимание на то, что некоторые кристаллы представляют собой зеркальное изображение других. Используя лупу и пинцет, он разделил два вида кристаллов; раствор одного типа кристаллов в воде вращал плоскость поляризованного света вправо, а раствор кристаллов другого типа - влево. Пастер осуществил расщепление механическим способом. К сожалению, очень немногие энантиомеры кристаллизуются в виде кристаллов зеркального типа, так что этот метод имеет больше историческое значение, чем практическое. Обычно же энантиомеры разделяют химическими или биологическими способами.
Упр. 1.Напишите структурные формулы (а) 1-хлорпропана, (б) 2-хлорпропана, (в) 1-хлорбутана, (г) 2-хлорбутана, (д) 2-хлорпентана, (е) 3-хлорпентана, (ж) 2-метил-1-хлорлбутана, (з) 2-метил-4-хлорбутана, (и) 2-метил-2-хлорбутана, (к) 2-метил-3-хлорбутана. Обозначьте звездочкой наличие у них стереоцентров. Для соединений, имеющих стереоцентры, изобразите стереохимические и каркасные формулы обоих энантиомеров. По системе (R-S) обозначьте конфигурацию каждого энантиомера.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

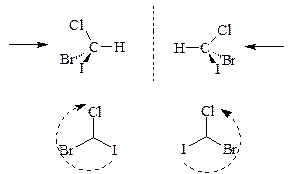
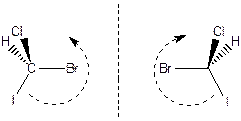

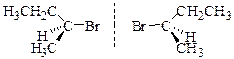
 приоритетнее альдегидной группы
приоритетнее альдегидной группы  , а винильная
, а винильная  - изопропильной
- изопропильной  .
.