|
|
Опыты по передаче с отцовской стороныПервые и очень спорные эксперименты по этому вопросу были проведены в конце 1970-х годов не на уровне генов, но на уровне функциональных характеристик иммунного ответа. Тэд Стил задал вопрос, приводят ли изменения иммунологических функций родителя (отца), вызванные активной обработкой антигеном, к каким-либо изменениям специфической или неспецифической иммунной реактивности у потомства, появившегося от скрещивания таких обработанных антигеном отцов с нормальными самками. Эти эксперименты были проведены на инбредных линиях мышей. Результаты оказались невоспроизводимыми — некоторые лаборатории смогли продемонстрировать отцовскую передачу специфических приобретенных иммунологических функций (или неспецифических нарушений), а другие не смогли. Первый положительный результат был получен Тэдом Стилом в соавторстве с Регом Гор-жински (Gorczynsky). Они использовали систему Медавара приобретенной неонатальной толерантности к чужим антигенам гистосовместимости (рис. 4.3). Эти эксперименты проводились в течение двух лет (1978—1979) в Онкологическом институте Онтарио (Торонто). Мы показали, что, если новорожденных самцов линии А повторно подвергать воздействию большого числа лимфоцитов линии В, то «толерантные» самцы могут передавать некоторые черты специфической толерантности к антигенам В-ткани своему потомству, полученному от , их скрещивания с нормальными самками линии А (рис. 6.1). , Иммунными эффекторными клетками в этом эксперименте почти несомненно были Т-лимфоциты, так как именно они вовлечены в реакцию отторжения. В более поздних экспериментах был проверен ответ В-лимфоцитов, причем была показана отцовская передача изменения силы ответа у потомков иммунизированных самцов.
Рис. 6.1. Передача приобретенной иммунолологической толерантности от отца. Эксперименты Горжински-Стила (Gorczynski-Steele). Мыши линии А приобрели толерантность к антигенам гистосовместимости линии В при инъекции новорожденным лимфоидных клеток линии В. (Это метод Медавара, см. рис. 4.3.) Эти мыши скрещиваются с нормальными самками линии А. У потомства проверяют образец киллерных Т-клеток на толерантность к антигенам гистосовместимости линии В. Согласно традиционной неодарвинистской теории потомство не должно быть толерантным, но в опыте было обнаружено много толерантных мышей. В контроле необработанных самцов линии А скрещивали с нормальными самками линии А. Родителей (контрольных и экспериментальных) и потомков содержали в одинаковых условиях в виварии. (По Steele E. J., Gorczynski R. M., Pollard J. W. In: Evolutionary Theory Path into the Future. Ed. J. W. Pollard. John Wiley, London, pp 217-237, 1984. Перепечатано с разрешения издателя). В этих экспериментах мы столкнулись с материальными и техническими проблемами. В таких опытах необходимо долговременное разведение 10-20 обработанных и необработанных самцов и учет изменений ответа или на пересадку кожи, или на иммунизацию, или на стимулированный антигеном ответ лимфоцитов одновременно у 50—100 потомков. Правильная интерпретация результатов возможна только при большом числе контрольных животных и проверок реакций на каждом этапе. Положительная передача была непостоянной, появляясь с большой частотой у одного-двух из десяти самцов (среди самцов наблюдалась изменчивость по признаку «частоты передачи потомству»). Эти данные подтверждали прямую проницаемость барьера Вейсмана при активной иммунизации, так как предполагается, что следующему поколению самцы передают только спермий. С иммунизированными матерями экспериментов не проводили, так как на плод и новорожденного прямо воздействуют антитела и лимфоциты, проникающие от матери или в матке, или после рождения с молозивом. Неудивительно, что эти эксперименты вызвали серьезные возражения и стали отчасти причиной эмоционального приема идей, упомянутых ранее, а невоспроизводимость результатов вызвала скептицизм у некоторых исследователей. Биологические тесты, использованные в некоторых из этих работ, очень изменчивы [10]. Сейчас технически возможны более точные эксперименты, так как новые молекулярные методы позволяют создать линии мышей, на которых можно обнаружить передачу информации от сомы к зародышевой линии. Однако частота такого события все еще неизвестна. «Печать» соматических мутаций и отбора стоит на всех V-генах зародышевой линии Наш интерес к анализу ДНК-последовательностей V-генов зародышевой линии начался с наблюдений нашего коллеги Гарри Ротенфлу. В 1992 г, выполняя свою диссертационную работу, он изолировал и секвенировал V-элементы зародышевой линии из Ig-локуса тяжелой цепи мыши (различие между «конфигурацией зародышевой линии» и «соматической конфигурацией» V-генов описано в гл. 4). Напомним, что перестроенные V(D)J-гены вариабельной области появляются только в зрелых В-клетках, и эти гены являются непосредственными мишенями антигензависимых процессов — соматического мутирова-ния и отбора в центре размножения. Данные Гарри Ротенфлу показали, что особенности ДНК-последовательностей соматической конфигурации свойственны и конфигурации зародышевой линии! Такое строение ДНК-последовательностей V-генов в зародышевой линии трудно объяснить в рамках любой теории, опирающейся на полное запрещение переноса генетической информации от сомы к зародышевой линии. Во-первьгх, V-элементы половых клеток никогда не могли быть прямой мишенью для естественного отбора (т. е. связывания антигена). Отбору подвергается только полностью собранный белок антитела (H+L гетеродимер) на поверхности В-лимфоцита, и только он проходит проверку на антигенсвязывающую функцию. Сами по себе V-элементы клеток зародышевой линии никогда не превращаются в РНК (не транскрибируются) или в белок (не транслируются). Они экспрессируются в зрелом В-лимфоците только после перемещения ДНК в хромосоме соматической клетки, приводящего к созданию типичного перестроенного V(D)J-участка (рис. 4.5). Функциональные исследования обнаружили, что только половина репертуара V-генов зародышевой линии появляется в V(D)J-последовательностях. Многие, возможно, никогда не использовались в зрелых V(D)J-перестройках и, по-видимому, никогда не подвергались отбору. Во-вторых, геном мыши и человека содержит много V-генов зародышевой линии (примерно по 100 для Н- и L-цепей). И хотя их последовательности в каждой из групп (Н или L) высоко гомологичны, но есть и довольно заметные различия. Изменчивость V-элементов зародышевой линии и для Н-, и для L-цепей характеризуется кривой Ву—Кэбота, т. е. высоко неслучайна (рис. 5.3). В предыдущей главе мы уже рассказали, что такая картина неслучайной изменчивости создается только прямым антигенсвязывающим отбором, действующим на молекулу антитела, расположенную на поверхности В-лимфоцита. Этот вопрос обсуждался в предыдущей главе. В-третьих, V-гены зародышевой линии мыши и человека «не затронуты» стоп-кодонами. Другими словами, многие V-гены зародышевой линии являются «открытыми рамками считывания». Обнаруживается статистически значимое снижение наблюдаемой частоты стоп-кодонов внутри кодирующих участков V-генов по сравнению с ожидаемой на основании процесса случайных мутаций. Это относится и к так называемым V-псевдогенам — нефункциональным V-генам, которые не могут экспрессироваться как мРНК и белок вследствие мутационных повреждений, нарушивших рамку считывания кодирующего участка или изменивших регуляторную последовательность. Считается, что такие поврежденные гены накапливают мутации, так как они не могут подвергаться действию отбора. Итак, низкая встречаемость точковых мутаций (или мутаций «сдвига рамки» из-за вставок или потерь оснований), приводящих к появлению стоп-кодона и в функциональных генах, и в псевдогенах предполагает существование механизма, который направлен на поддержание «открытой рамки считывания» V-генов зародышевой линии. Однако открытая рамка считывания может подвергаться отбору только на уровне связывания антигеном, связывания интактного гетеродимера, расположенного на поверхности клетки, и антигена. Таким образом, структура ДНК-последовательности V-генов зародышевой линии млекопитающих предлагает нам сложную загадку. Согласно модели случайного дрейфа, эти гены должны накапливать довольно большое число фоновьк мутаций. Поскольку этого не происходит, то следовательно, эти последовательности несут следы отбора на уровне белка. Указанные особенности последовательностей V-генов наблюдаются у всех изученных до сих пор позвоночных, от хрящевых рыб, амфибий (лягушки) до кроликов, овец, мышей и человека. Противоречия станут еще глубже, если рассмотреть ДНК-последовательности V-генов зародышевой линии у кур, изученные французскими и американскими исследователями под руководством Жан-Клода Вейля (Weill) и Крейга Томпсона (Thompson) в течение последних 10 лет. У кур процесс образования антител несколько отличается от такового у мышей и человека. Первое отличие заключается в том, что локусы тяжелой и легкой цепей содержат только по одному функциональному V-элементу, включающему сигнальную последовательность для активирующего рекомбинацию генов фермента (RAG), который обеспечивает перестройку ДНК. Вверх (к 5' концу) от этого функционального V-гена находится 20—100 псевдогенов. Они в основном нефункциональны из-за того, что у них укорочен участок, контролирующий транскрипцию (промотор), который может тянуться до последовательности, кодирующей лидерньш пептид (L). У них также отсутствует и сигнальная последовательность для RAG-фермента. Эти псевдогены тесно упакованы в ДНК зародышевой линии, по краям каждого кодирующего участка расположено всего несколько сот (самое большое) оснований. В отличие от них V-элементы генов зародышевой линии у человека и мыши отделены друг от друга 10—20 килобазами ДНК. Таким образом, размер IgV локусов курицы составляет примерно 1/20 размера этих локусов мыши и человека. В развивающихся куриных В-лимфоцитах происходит перестройка единственного интактного V-гена и образование функционального вариабельного V(D)J-гена. Затем к нему добавляются фрагменты разной длины (5—100 оснований) расположенных выше V-псевдогенов. Этот процесс называют генной конверсией. Разные результаты генной конверсии в разных В-клетках приводят к образованию большого репертуара V(D)J-последовательностей. Такой источник разнообразия функциональных антител так же эффективен, как у мышей и человека, но требует гораздо меньшего (1/20) количества ДНК зародышевой линии. Но самое поразительное в строении V-псевдогенов это то, что если сравнить их ДНК-последовательности с помощью компьютерных программ, то обнаруживается структура By— Кэбота»! (рис. 6.2). Более того, если различия между псевдогенами обусловлены вставкой и потерей нуклеотидов в кодирующих участках, они всегда кратны трем (т. е. триплету); таким образом, сохраняется правильная трансляционная рамка считывания! Это показано на рис. 6.2. Напомним, что триплетный ко-дон определяет аминокислоту в цепочке белка (см. приложение). Вдобавок у кур псевдогены тяжелой цепи на 3'-(правом) конце несут короткую D-последовательность (и все они находятся в предпочтительной рамке считывания, наблюдаемой только в соматически экспрессирующихся V(D)J-последовательностях). Псевдогены как тяжелых, так и легких цепей отличают вставки или потери нуклеотидов, которые, как известно, происходят в В-лимфоцитах при образовании V(D)J-пepeстройки. Эти вставки и потери создают третий гипервариабельный участок! Такие действительно поразительные и необычные свойства обнаружены в ДНК зародышевой линии, кодирующей псевдогены. Она несет «печать» соматических событий.
Рис. 6.2. Вариабельность ДНК и аминокислот (Ву-Кэбот) V-псевдогенов зародышевой линии у кур. Графики Ву—Кэбота для вариабельных областей псевдогенов 18 тяжелых {А) и 25 легких (Б) цепей генома кур. И для тяжелых, и для легких цепей наблюдаются неслучайные структуры Ву—Кэбота, свидетельствующие об антигенсвязывающем отборе В-клеток на уровне белка Ig. Этот результат противоречит структуре их последовательностей, которая гарантирует, что сами по себе эти гены никогда не экспрессируются как белковая последовательность. Верхние графики показывают вариабельность нуклеотидов в ДНК-последовательностях по длине участка, а нижние — вариабельность аминокислот (после трансляции успешной ДНК-последовательности триплетных кодонов в аминокислотную последовательность, см. приложение). Первое основание или аминокислота предполагаемого кодирующего участка обозначено как положение 0. Обратите внимание, что гипервариабельные последовательности совпадают с антигенсвязывающим центром (CDR), такая картина графика Ву—Кэбота ожидается для функционального белка вариабельной области (рис. 5.3). Положения, в которых произошли вставки (+) или потери (-) триплетов оснований обозначены светлыми стрелками. Относительные положения CDR1, CDR2 и CDR3 показаны на диаграммах под графиками. Появление вставок или потерь оснований наборами триплетных кодонов в правильной рамке считывания (см. приложение) снова свидетельствует об антигензависимом отборе, действующем на уровне белка — что невозможно, так как эти гены — псевдогены! Разумное объяснение таково, что эти последовательности оснований в V-псевдогенах зародышевой линии поддерживаются как открытые рамки считывания обратной связью сомы и зародышевой линии функциональных V(D)J-последовательностей после направляемого антигеном соматического отбора. (По Rothenfluh H. S., Blanden R. V., Steele E. J. Immuno-genetics, vol. 42: 159-171, 1995 с разрешения издателя, Springer-Verlag Gmbh &Co. Kg.) Следовательно, куриные псевдогены — это чудовищный вызов традиционной молекулярной генетике, основанной на строгой неодарвинистской парадигме. Парадоксально, у них проявляются все черты прямого антигенсвязывающего отбора на уровне антитела, хотя ДНК-последовательности, характерные для зародышевой линии, транскрибируются (в мРНК) и транслируются (мРНК в белок) только по частям, после процесса соматической генной конверсии. Такая структура ДНК-последовательностей разумно объясняется только генетической моделью отбора антигеном соматического V(D)J-гена и последующей обратной связи генов вариабельной области сомы и зародышевой линии (наиболее вероятно, через РНК-> ДНК-копирование, или обратную транскрипцию). См. рис. 6.3 и рис. 1.2. Структура Ву—Кэбота и другие соматические черты V-генов и псевдогенов зародышевой линии позвоночных (особенно поразительные свойства псевдогенов кур, описанные выше) указывают на действие процесса обратной связи генов сомы и зародышевой линии, активного в течение 400—500 миллионов лет эволюции V-генов. Следовательно, сейчас у нас есть причины для введения в современную эволюционную теорию третьей неоламарковской концепции: прямое проникновение через барьер Вейсмана некоторых семейств генов, например, V-генов иммуноглобулинов.
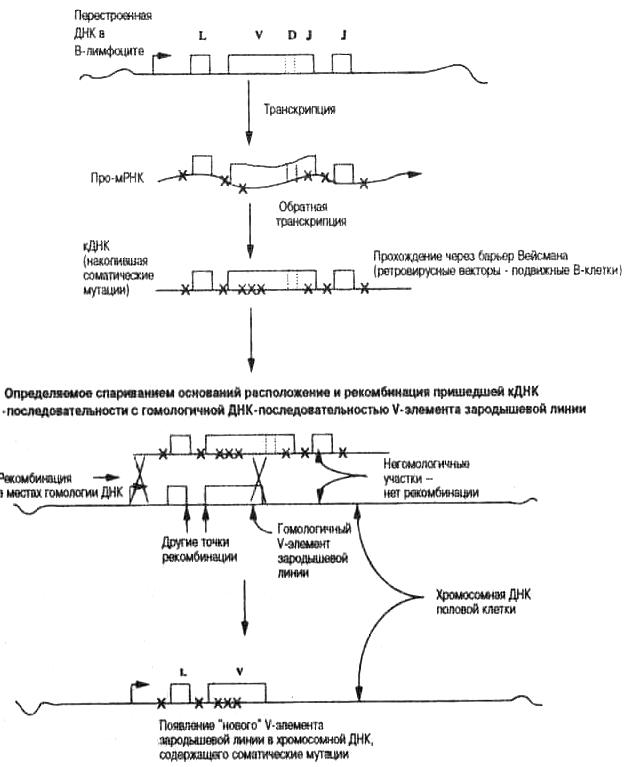
Рис. 6.3. Обратная связь сомы и зародышевой линии (тяжелая цепь). В гл. 5 говорилось, что соматические мутации накапливаются в вариа-6enbHbixV(D)J-reHax В-лимфоцитов (рис. 5.5 и 5.6). Мутантные обратные транскрипты (кДНК), доставленные в половые клетки подвижными В-клетками и/или ретровирусами, встраиваются в ДНК зародышевой линии в результате гомологичной рекомбинации. Картина рекомбинации V-генов зародышевой линии установлена с помощью алгоритма генетической рекомбинации, разработанного Джорджем Уайлером (см. текст и Weiller et al., 1998). Главные точки рекомбинации в зародышевой линии обнаружены в точке начала транскрипции, на границе между L-V интроном и концом кодирующего V-участка. Этот результат согласуется с предположением о следах интеграции, которые обсуждаются в этой главе. Этот процесс показан и на рис 1.2, но не так подробно. См. также подписи к рис. 4.5, 5.5 и 5.6. Простейшие модели этого процесса включают создание кДНК по матрице про-мРНК с помощью обратной транскрипции и последующую доставку этой копии в репродуктивные ткани мобильными клетками (например, лимфоцитами) или эндогенными ретровирусами, действующими как «генные челноки». (Напомним, что предполагаемый механизм соматического гипермутирования, обсуждаемый в предыдущей главе, также включает создание кДНК.) Последнее — это гомологич-ная рекомбинация, причем созданная кДНК замещает исходную последовательность зародышевой линии. У нас нет способа оценки частоты возникновения таких событий в ходе эволюции, хотя сила «соматической печати», которую мы видим на ДНК зародышевой линии, заставляет считать их довольно частым эволюционным событием. «Следы интеграции» сомы в зародышевую линию Модель соматического отбора, объясняющая эволюционный цикл V-генов антител, приведена на рис. 1.2 и 6.3. Мы предполагаем, что новый варианту-последовательности зародышевой линии «рождается» в соме в результате гипермутирования «выбранного» антигеном перестроенного V(D)J-гена вариабельной области, экспрессирующегося в В-лимфоците. Интенсивные циклы соматического гипермутирования и отбора антигеном в центре размножения приводят к появлению новых, успешных V(D)J-последовательностей с мутациями в определяющих ком-плементарность участках (CDR, от англ complementarity-determining regions), или гипервариабельных участках, которые вступают в контакт с антигеном. Затем эти новые последовательности ДНК доставляются в репродуктивные ткани, где они совмещаются с существующим V-геном, имеющим очень похожую последовательность. После этого происходит процесс, который называется гомологичной рекомбинацией. Он включает разрыв хромосомной ДНК и ее воссоединение с концами нового гена, который, таким образом, интегрируется (встраивается) в хромосому (этот процесс обозначен перекрещивающимися линиями на рис. 6.3). Все свойства V-генов зародышевой линии, описанные в этой книге, согласуются с этим «жизненным циклом» от сомы к зародышевой линии. Но мы нашли еще одно свидетельство, согласующееся с гипотезой движения информации от сомы к половым клеткам. А именно, если соматическая генная последовательность встраивается в зародышевую линию в результате рекомбинации, то мы должны увидеть свидетельства процесса рекомбинации самого по себе (рис. 6.3). Одним из таких свидетельств может быть распределение событий «вставка/потеря» нуклеотидов. Когда две гомологичные двухцепочечные спирали ДНК рекомбинируют, они должны разрушаться (разрезаться ферментом нуклеазой) и затем воссоединяться (с помощью фермента лигазы). Этот процесс может быть неточным и приводить к потере или вставке нуклеотидов на концах цепочек ДНК. Соответственно, появляются или потери, или вставки нуклеотидов в месте соединения. Поэтому среди последовательностей V-генов зародышевой линии должны быть вставки и потери разной длины по границам генов. В том же смысле, в каком структура Ву—Кэбота служит показателем антигенсвязывающего отбора, неслучайное распределение событий вставка/делеция должно свидетельствовать о существовании обратной связи генов сомы и зародышевой линии. И мы нашли это свидетельство не только в своих данных, полученных на мышах, но и во всех других семействах V-генов зародышевой линии позвоночных. Такое неслучайное распределение рекомбинационных ошибок точно соответствует предсказаниям модели «от сомы к зародышевой линии». На этом уровне наших знаний, по крайней мере для эволюционной генетики V-элементов зародышевой линии, мы не знаем иного объяснения наблюдаемой картине (кроме обращения к разумному манипулятору генами, или божественному вмешательству, а для этого нет оснований!). Недавно мы начали разрабатывать другой подход к более точной идентификации рекомбинационных сайтов в V-генах зародышевой линии и, таким образом, к «более аккуратному» изучению следов интеграции сомы в зародышевую линию. Мы объединились с Джоржем Уайлером (Weiller) из Школы биологических исследований при Австралийском национальном университете. Джордж разработал новый способ определения сайтов рекомбинации в генных последовательностях, эффективность которого доказана на известных бактериальных ДНК-последовательностях. Поэтому мы могли точно локализовать сайты рекомбинации в коллекции последовательностей V-генов зародышевой линии. Результаты этой работы четко показывают, что рекомбинация в V-генах зародышевой линии происходит в местах, предсказанных теорией встраивания кДНК (обратных транскриптов), возникающей из несплайсированных или сплайсированных про-мРНК соматических L-V(D)J-генов. Таким образом, в зародышевой ДНК мы находим следы интеграции, которые согласуются с «печатью процессинга» соматической РНК. Этот потрясающий результат невозможно логично интерпретировать с позиций традиционных неодарвини-стских взглядов, но они полностью согласуются с предсказаниями теории соматического отбора. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|