|
|
Основные формулы для расчетов
1)Степень обезвоживания карналлита рассчитывается по содержанию хлорида магния и воды в обезвоженном карналлите. Сначала определяют молекулярное отношение Н2О к MgCl2 по формуле:
n = H2O * М(MgCl2) MgCl2 * M(H2O)
Где M(MgCl2) = 95,312 и M(H2O) = 18 – молекулярные массы хлорида магния и воды. Затем определяют степень обезвоживания:
Q = (6 – n) * 100 %
где 6 – число молекул воды в исходном карналлите. Степень гидролиза Г = 2,36 * MgO * 100 % (MgCl2 + 2,36MgO)
где 2,36 – отношение молекулярной массы хлорида магния и оксида магния, М(MgO) = 24.312 + 16 = 40.312 г/моль; M(MgCl2) = 24.312 + 35.5*2 = 95.312 г/моль; M(MgCl2) / М(MgO) = 95,312 / 40,312 = 2,36
Задача: Рассчитать степень обезвоживания и степень гидролиза карналлита, если содержание хлорида магния в обезвоженном карналлите 48 %, содержание воды 0,4 %, содержание оксида магния 3%. Решение: 1) Определяем молекулярное отношение воды к хлориду магния n = H2O * 95.312 = 0,4 * 95,312 = 0,0441 MgCl2 * 18 48 * 18
2) Определяем степень обезвоживания Q = (6 – n) * 100 % = (6 – 0,0441) * 100 % = 99,3 % 6 6
3) Определяем степень гидролиза Г = 2,36 * MgO * 100 % = 2,36 * 3 * 100 % = 12,85 % (MgCl2 + 2,36MgO) (48 + 2,36 * 3)
Вопросы: 1. Какие руды используются для получения магния? 2. Что такое искусственный карналлит? 3. Как получают искусственный карналлит? 4. Как происходит процесс обезвоживания искусственного карналлита? 5. Что такое гидролиз? Как можно снизить степень гидролиза? 6. В каких печах производится обезвоживание искусственного карналлита? 7. Из каких частей состоит печь ТВ? 8. В чем преимущества печей кипящего слоя по сравнению с трубчатыми печами? 9. Почему карналлит после обезвоживания в печах КС или ТВ нельзя использовать для электролиза магния? 10. На какой стадии обезвоживания применяется печь СКН и в составе какой установки? 11. Для чего при хлорировании оксида магния в шихту вводится углерод? 12. Опишите принцип действия хлоратора? Хлормагниевая АТС
Эта схема применяется в двух вариантах: 1 вариант – при хлорировании магнезита 2 вариант – при получении хлорида магния из морской воды (обезвреживание бишофита).
1 вариант – хлорирование магнезита MgCO3 Магнезит MgCO3
Дробление, измельчение
Смешение
Брикетирование
Хлорирование
безводный MgCl2
электролиз Рисунок 1.7 – Хлорирование магнезита MgCO3 Основные стадии:
Смешение и брикетирование – магнезит смешивается с коксом и связующим – каменноугольным пеком = магнезитовая шихта в виде брикетов
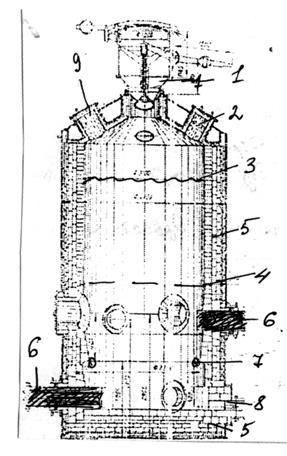
Хлорирование в электрических шахтных печах В отдельных зонах печи протекают следующие процессы: - нагревание и подсушка брикетов, удаление летучих фракций из пека; - нагревание поступающей в печь хлорвоздушной смеси; - термическая диссоциация карбонатов, хлорирование оксидов железа, алюминия и кремния FeO, Al2O3, SiO2, основной массы MgO и CaO с образованием твердых MgCl2 и CaCl2; - расплавление MgCl2 и CaCl2 и хлорирование остатка MgO и CaO; - накопление и периодический выпуск расплавленного технического безводного MgCl2. Печь имеет стальной кожух с шамотной футеровкой, 2 ряда угольных электродов в нижней части печи. Угольные брикеты выполняют роль тела сопротивления (1000 0С). Хлор поступает через фурмы, а шихта сверху. Выпуск жидкого продукта через летку.
1 – загрузочное устройство; 2 – ремонтный люк; 3 – уровень загрузки шихты; 4 – уровень загрузки брикетов; 5 – огнеупорная кладка; 6 – угольные электроды; 7 – фурмы; 8 – летка; 9 – газоход Рисунок 1.8 – Устройство шахтной электрической печи
Поведение примесей: - CaCl2 остается в конечном продукте; - FeCl3 улетучивается из зоны реакции и конденсируется в верхней части печи; - Al2O3, SiO2 частично хлорируются с образованием AlCl3 и SiCl4, удаляются с отходящими газами; - Al2O3, SiO2, MgO частично взаимодействуют, образуя корку силикатов, которая затем мешает сходу шихты. Состав отходящих газов: СО, СО2, HCl, MgCl2. Основные реакции:
MgO + Cl2 + C = MgCl2 + CO MgO + Cl2 + C = MgCl2 + CO2 MgO + Cl2 + CO = MgCl2 + CO2
2 вариант – Обезвоживание бишофита Это схема получения магния из морской воды Морская вода гашеная известь Ca(OH)2
Осаждение
Пульпа Mg(OH)2
Фильтрация
Кек Mg(OH)2
MgCl2 (15 - % ный)
Выпаривание
MgCl2 * 6H2O
2 стадийное обезвоживание
MgCl2 * 1,25 H2O
электролиз
Рисунок 1.9 - Обезвоживание бишофита
Основные стадии: 1. Осаждение гашеной известью MgCl2 + Ca(OH)2 = CaCl2 + Mg(OH)2 2 Сгущение в сгустителях – получение пульпы 3 Фильтрация – промывка и отделение кека (25%-ный MgO, CaCl2, CaCO3) 4 Нейтрализация смесью кислот – для удаления примесей и получения MgCl2: Mg(OH)2 + HCl = MgCl2 + 2H2O CaCl2 + H2SO4 = Ca2SO4 + 2HCl CaCO3 + HCl = CaCl2 + H2O + CO2 5 Выпаривание – получение бишофита MgCl2 * 6H2O 6 Обезвоживание бишофита
Обезвоживание бишофита протекает более сложно, чем обезвоживание карналлита, по схеме
117 0C 185 0C 242 0C MgCl2 * 6H2O → MgCl2 * 4H2O → MgCl2 * 2H2O → MgCl2 * H2O
Удаление последней молекулы воды сопровождается гидролизом: 300 – 500 0C MgCl2 * H2O + H2O → MgOHCl + HCl
Затем при температуре 554 0С начинается разложение MgOHCl:
MgOHCl → MgO + HCl
Чтобы сдвинуть равновесие реакции влево окончательное обезвоживание проводят в атмосфере хлорида водорода.
Обезвоживание бишофита намного сложнее, чем карналлита, т. к. хлористый магний легче гидролизуется, чем карналлит. Бишофит, если его сушить на воздухе при обычной температуре, медленно отдает лишь 5 молекул воды. Последнюю молекулу удается испарить лишь при температуре выше 2400С, когда энергично протекает реакция гидролиза. Реакциям гидратации сопутствуют реакции гидролиза. 1стадия обезвоживания - нагревание его на воздухе, Печи ТВ. Основное требование – соблюдать режим нагрева, т.к. при 106 0С бишофит плавится, вспенивается, процесс замедляется, зарастание печи. 2 стадия – нагревание MgOHCl в атмосфере хлороводорода и хлорида аммония NH4Cl. Печь шахтная либа ТВ. Атмосфера паров хлороводорода. Бишофит сушат в трубчатых вращающихся печах в две стадии: сначала в токе воздуха при медленном повышении температуры до 2000С, предупреждая этим плавление соли и гидролиз, затем полное обезвоживание проводят в присутствии угля и при подаче хлора. В результате реакции Cl2 + H2O + C = 2HCl + СО Получается хлористый водород, препятствующий гидролизу соли. Помимо применения кислотоупорной аппаратуры, при работе на бишофите необходимо дорогое выпаривание его природных рассолов. По этим причинам бишофит используют для производства магния только в случае, если отсутствуют карналлит и магнезит.
Получение хлорида магния из морской воды(США, г. Веласко) (смот) !
Исходные материалы: морская вода, очищенная от взвешенных примесей на ситах, и промытые устричные раковины, практически состоящие из чистого CaCO3. Раковины обжигают при 1200 – 1400 0С во вращающейся трубчатой печи. Полученную смесь гасят водой, получая известковое молоко, из которого при сгущении в сгустителях осаждается Са(ОН)2 в виде тяжелой пульпы. Слив из сгустителя примешивают к воде = гашеная известь. Морскую воду перекачивают в смеситель, где её смешивают с известковым молоком. В результате получают легко осаждающийся и хорошо фильтруемый осадок Mg(OH)2 по реакции: MgCl2 + Ca(OH)2 = CaCl2 + Mg(OH)2 Соединения бора остаются в растворе. Магнезитовая пульпа поступает в сгуститель, где после сгущения она содержит 12 % Mg(OH)2. В пульпу переходят практически весь магний, большая часть кальция и углекислые соли из морской воды. Затем пульпу фильтруют на пластинчатых вакуум – фильтрах, получая кек, содержащий 25 % Mg(OH)2, примеси CaCl2, CaCO3. Кек разбавляют 10 % - ным раствором оборотного MgCl2, а затем нейтрализуют смесью соляной и серной кислот, полученной после регенерации анодного газа электролизеров. Mg (OH)2 + HCl = MgCl2 + 2Н2О Карбонаты разлагаются с выделением СО2, а содержание сульфатов несколько увеличивается за счет поступающей серной кислоты. CaCO3 + HCl = CaCl2 + Н2О + СО2 CaCl2 + H2SO4 = Ca2SO4 + 2HCl Каждая серия нейтрализаторов состоит из двух последовательно соединенных баков с мешалками. В первый бак подают весь кек и 75 % всей кислоты, необходимой для полной нейтрализации. Окончательная нейтрализация происходит во втором баке, где рН = 6,5. При концентрировании раствора выпаркой снижается растворимость хлористого натрия и сульфата кальция, присутствующих в растворе. Т. к. выпадает осадок Ca2SO4, обычные трубчатые аппараты не пригодны, Используются выпарные аппараты с погруженным горелками. Аппарат представляет собой стальной бак с крышкой, футерованный изнутри кислотоупорным кирпичом. Через отверстие в крышке опускается труба с приваренной горелкой и устройством для электрического зажигания. Уровень раствора в баке на 0,5 м ниже крышки. Подача раствора автоматически. Отработанные газы отводятся через трубу. КПД аппарата 85 %. В результате получают бишофит MgCl2 * 6Н2О.
Промышленные способы прямого обезвоживания не разработаны, т.к.: - сильная коррозия аппаратуры; - большие потери MgCl2 из-за гидролиза; - получение хлора низкой концентрации; -сложность удаления последней молекулы воды.
Полупромышленные способы получения безводногоMgCl2
1 Применение полувыпарных аппаратов с полупогруженными горелками 2 Обезвоживание бишофита в 3-камерной печи КС (высокая степень гидролиза до 38 %) 3 Обезвоживание бишофита с помощью распылительных сушилок РКС 4 Окончательное обезвоживание в токе HCl или NH4Cl 5 Магниетермический способ в производстве титана 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 Кокс
Кокс  Пек
Пек
 магнезитовая шихта
магнезитовая шихта хлор
хлор



 Сгущение
Сгущение