
|
|
Применение квантовой химии в спектроскопии и фотохимии.12 Поскольку спектроскопия имеет дело с возбужденными состояниями, геометрические параметры которых обычными экспериментальными методами определить трудно, в этих разделах роль квантовой химии возрастает. В этих двух разделах химии имеет место взаимодействие электромагнитного излучения с атомами и молекулами. При этом могут происходить процессы поглощения излучения (когда молекула или атом получают энергию) и испускания (эмиссии), когда молекула или атом теряет энергию (высвобождают ее), причем высвобождаемая или поглощаемая энергия равна:
При поглощении кванта света молекула или атом переходит за время порядка 10-14 с в возбужденное состояние. Излучает энергию, как правило, молекула, переходя из возбужденного состояния в основное. Проиллюстрировать взаимосвязь между основным и возбужденным состояниями можно при помощи следующей диаграммы:
В возбужденных состояниях, по крайней мере, в приближении Борна-Оппенгеймера, молекула обладает избыточной по сравнению с основным состоянием электронной, колебательной или вращательной энергией. Она описывается другой по сравнению с основным состоянием волновой функцией. Одной из основных задач спектроскопии является определение расстояния между энергетическими уровнями возбужденного и основного состояний, DЕ. Поскольку для электромагнитного излучения
где С - скорость света в вакууме (»3·105 км/с), то DЕ можно выражать не только в единицах энергии, но и в единицах длины волны, а также в единицах так называемых волновых чисел (определенных как величины, обратные длине волны). Атомы и молекулы могут находиться в большом количестве возбужденных состояний. Переходы между ними и основным состоянием будут характеризоваться спектром испускания и поглощения. Реальные спектры поглощения и испускания состоят не из отдельных линий, но представляют собой полосы, т.е. слившиеся линии. Причина такого уширения заключается в хаотичности (теплового) движения атомов и молекул (по крайней мере, - одна из причин). Обычно, в приближении Борна-Оппенгеймера, можно рассматривать электронное, колебательное и вращательное возбуждения по отдельности, причем
и
Поэтому электронные спектры (в которых переход осуществляется между двумя электронными уровнями) могут обладать колебательной структурой, колебательные спектры - вращательный, вращательные - квадрупольный и т.д. Молекула может отдать свою избыточную энергию не только благодаря испусканию или поглощению кванта света, но и через столкновения или химическую реакцию (т.е. безызлучательно). Выражение (19) определяет лишь возможность излучательного обмена энергией, т.е. возможность поглощения или испускания кванта света. Однако вероятность такого поглощения связана прежде всего с дипольным моментом электронного перехода,
где yi - волновая функция возбужденного состояния; yj волновая функция основного состояния;
Лишь тогда, когда интеграл Физический смысл дипольного момента перехода можно объяснить следующим образом:
Но члены Анализ выражения
Тогда
Анализ интеграла Поскольку спиновые волновые функции s взаимно ортогональны.
Т.о., интеграл дипольного момента перехода равен 0, если yi и yj имеют различные спиновые волновые функции. Поэтому переходы между состояниями, имеющими различные волновые функции, т.е. состояниями различной мультиплетности, строго запрещены. Триплетным состоянием назовем состояние a(х1)a(х2) и b(х1)b(х2), а синглетным - a(х1)b(х2) и a(х2)b(х1).
Триплетные состояния.
Синглетные состояния. Спиновый множитель для волновой функции триплетного состояния:
Для синглета
Тогда
Т.о. наше утверждение доказано. Вращательный вклад
Т.е. наиболее вероятны переходы, когда колебательными уровнями с одинаковыми вращательными квантовыми числами. Аналогично, анализ интеграла перекрывания колебательных уровней приводит к выводу, что наиболее вероятны переходы между состояниями с одинаковыми колебательными числами. Т.о. мы установили так называемые правила отбора для спектров: (1) Переходы между состояниями разной мультиплетности происходят с очень малой вероятностью; (2) Наиболее вероятны переходы между колебательными уровнями с одинаковыми колебательными квантовыми числами; (3) Наиболее вероятны переходы между вращательными уровнями с одинаковыми вращательными квантовыми числами. Анализ члена (4) Между волновыми функциями, расположенными в одной и той же области пространства (поскольку в этом случае больше подынтегральное выражение и, следовательно, больше интеграл); (5) между волновыми функциями, для которых выражение

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (20)
(20) (21)
(21) (22)
(22) (23)
(23) (24)
(24) (25)
(25) - оператор дипольного момента перехода, причем
- оператор дипольного момента перехода, причем (26)
(26) - оператор радиус-вектора электрона n.
- оператор радиус-вектора электрона n. , вероятность перехода отлична от нуля. Чем больше
, вероятность перехода отлична от нуля. Чем больше  , тем лучше поглощает (или излучает) молекула или атом электромагнитное излучение, причем вероятность такого перехода прямопропорциональна
, тем лучше поглощает (или излучает) молекула или атом электромагнитное излучение, причем вероятность такого перехода прямопропорциональна  .
.
 - вероятность нахождения электронов в основном состоянии j в точке k×Dx;
- вероятность нахождения электронов в основном состоянии j в точке k×Dx;  - вероятность нахождения электронов в точке k×Dx в возбужденном состоянии i. Произведение этих вероятностей есть вероятность нахождения электронов в точке k×Dx, описываемая волновой функцией в возбужденном состоянии i и в основном состоянии j, т.е. вероятность перехода в точке k×Dx с волновой функцией j, в основное состояние i.
- вероятность нахождения электронов в точке k×Dx в возбужденном состоянии i. Произведение этих вероятностей есть вероятность нахождения электронов в точке k×Dx, описываемая волновой функцией в возбужденном состоянии i и в основном состоянии j, т.е. вероятность перехода в точке k×Dx с волновой функцией j, в основное состояние i. (27)
(27) (28)
(28) начнем со спинового члена.
начнем со спинового члена. (29)
(29) (30)
(30)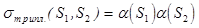 или b(S1)b(S2) (31)
или b(S1)b(S2) (31) (32)
(32) (33)
(33) (34)
(34) , когда i=j.
, когда i=j. приводит к следующим заключениям. Наиболее вероятны переходы:
приводит к следующим заключениям. Наиболее вероятны переходы: является четным.
является четным.