
|
|
Теоретические методы описания химических реакций.12 Описание молекул при помощи квантовой химии. В молекулах, в которых межэлектронное отталкивание не учитывается явно, полная энергия системы
где ni - числа заполнений i-той МО; Ei - энергия i-той МО.. В МОХ:
a - кулоновский, а b - резонансный параметры. Для несопряженных органических соединений с большой точностью удается рассчитать теплоты образования. В отличие от этого в сопряженных соединениях сумма всех энергий МО не равна полной энергии системы из отдельных связей. Разность энергий между системой с сопряженинм и системой с изолированными связями носит название энергии резонанса. Теоретически подобную величину, называемую энергией делокализации, (ЕD), определяют как разность между p-электронной энергией системы (W) и p-электронной энергиейнаиболее выгодной в энергетическом отношении кекулевксой структуры (WК),
Потенциалом ионизации в рамках этого метода называют энергию, которую необходимо сообщить системе, чтобы удалить из нее один из электронов. Сродство к электрону является энергией, которая высвобождается, когда к системе присоединяется один электрон.
(а) - основное состояние; (б) - состояние после ионизации (катион-радикал); (в) - состояние после присоединения электрона (анион-радикал); (г) - состояние после возбуждения системы с минимальной энергии возбуждения.
Таким образом в рамках простого метода Хюккеля i-ый потенциал ионизации равен энергии i-ой МО. Для анализа свойств молеку, связанные с волновой функцией, полезным является анализ заселенности по Малликену. Для простоты рассмотрим двухцентровую (локализованную на двух атомах) МО
Пусть АО нормированы, но неортогональны. Тогда
- интеграл перекрывания;
Пусть k - число электронов, занимающих данную МО, тогда
Число
В случае приближения МО ЛКАО
Если на каждом атоме локализована лишь одна АО и
тогда.
Величина
будет характеризовать заселенность перекрывания и называться порядком связи между атомами m и n. В приближении Хюккеля, если считать, что
то
В p-электронном приближении Хюккеля его можно считать мерой вклада двойной связи в реальную связь, соединяющую два атома.
Теоретические методы описания химических реакций. Конечной целью квантовой химии является разработка теоретических методов описания химических реакций. Существует несколько подходов к решению этой задачи. В первом из них, носящем название метода поверхностной потенциальной энергии, строится зависимость полной энергии реагирующей молекулы или нескольких молекул от одного или нескольких геометрических параметров. В случае зависимости от единственного геометрического параметра, называемого координатой реакции, метод ППЭ особенно нагляден.
На этом рисунке изображена зависимость полной энергии системы из трех атомов Х, Y и Z от расстояния между атомами Y-Z (координаты реакции). Пусть в начальном состоянии реагент Х находится далеко от молекулы со связью Y-Z. По мере приближения реагента Х к молекуле в результате межатомного отталкивания потенциальная энергия системы возрастает, причем одновременно с приближением атома Х в молекуле удлинняется связь Y-Z. В точке максимума энергии, соответствующей геометрии реагирующей системы в случае переходного состояния (или активированного комплекса), расстояния X-Y и Y-Z приобретают равновесные значения, типичные для рассматриваемой реагирующей молекулы. Дальнейшее сближение реагентов X и Y-Z (уменьшение длины связи Y-Z) приводит к уменьшению потенциальной энергии системы. В конце концов расстояние Y-Z становится очень большим, а X-Y приобретает значение, типичное для молекулы X-Y. Последняя ситуация соответствует продуктам реакции. Экспериментальный энергетический барьер, называемый энергией активации, представляет собой разность потенциальных энергий начального и переходного состояний. Пример применения этого подхода приведен на рис.1, где показана трехмерная ППЭ для системы {HN3 + NH}T . (по оси Х отложено расстояние от нитренного атома азота до срединного, по оси Y - между атомом азота нитрена и нитренным атомом азота азида).
Рис.1 Трехмерна ППЭ для системы {HN3 + NH}T
Однако полный расчет ППЭ часто является слишком сложной и дорогостоящей про-цедурой. Поэтому квантовую химию можно применять для построения полуколичественных схем. Существует три возможных подхода. Первый состоит в анализе свойств основного сос-тояния одного из реагирующих веществ. Чаще всего анализируются такие свойства как распределение электронной плотности, порядки связей и т.п. Затем пытаются коррелировать указанные характеристики с реакционной способностью. Такой подход носит название ме-тода изолированной молекулы.
В основе второго подхода лежит расчет потери электронной энергии, связанной с образованием активированного комплекса. Он носит название теории локализации.
Третий подход представляет собой комбинацию первых двух и основан на исследовании взаимодействия между наивысшей заполненной МО одной молекулы и наинизшей незаполненной МО другой молекулы. Такой подход носит название теории граничных потенциалов. Рассмотрим эти подходы более подробно. Начнем с приближения изолированной молекулы. Чаще всего для предсказания реакционной способности используют такие характеристики, как плотность заряда, свободная валентность, поляризуемость и т.д. Сочетание ароматических солей диазония с фенолами включает атаку катионом диазония (RN2+) фенокси-аниона. Распределение зарядовых плотностей в a- и b-нафтолах можно проиллюстрировать при помощи следующих диаграмм:
анион a-нафтола анион b-нафтола Красный краситель, образующийся в результате сочетания, бензолдиазонийхлорида с 2-нафтолом, получается в результате атаки катиона диазония в положение 1. В случае 1-нафтола образуется смесь красителей, получающихся при атаке как в положение 2, так и в положение 4. Кроме того, для производных b-нафтола реакция не происходит совсем, если положение 1 блокировано (как, например, в случае 1-метил-2-нафтола). Обобщая полученные результаты, можно сделать следующие выводы. Нуклеофильные реагенты с большей вероятностью атакуют в молекуле атомы, на которых локализована минимальная электронная плотность: причем, если сравнивать несколько молекул с аналогичным строением реакционного центра, то чем меньше электронная плотность на реакционном центре атакуемой молекулы, тем легче протекает нуклеофильная атака и больше скорость реакции. С другой стороны, электрофильные реагенты с большей вероятностью атакуют в молекуле атомы, на которых локализована максимальная электронная плотность. Фактические известные эмпирические правила по ориентации замещения в ароматическое кольцо есть отображение этих двух правил. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (1)
(1) (2)
(2) (3)
(3)




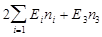


 (4)
(4) (5)
(5) (6)
(6) (7)
(7)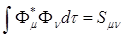 (8)
(8) (9)
(9) (10)
(10) - заселенность перекрывания. Его можно интерпретировать как степень накопления электронного заряда между двумя атомами в молекуле, т.е. он имеет отношение к прочности рассматриваемой связи. В пердставлении, что величина этого члена равномерно распределяется между атомами, образующими связь, Малликен предложил определять электронный заряд Qm на атоме m (ядро которого совпадает с центром m) следующим образом
- заселенность перекрывания. Его можно интерпретировать как степень накопления электронного заряда между двумя атомами в молекуле, т.е. он имеет отношение к прочности рассматриваемой связи. В пердставлении, что величина этого члена равномерно распределяется между атомами, образующими связь, Малликен предложил определять электронный заряд Qm на атоме m (ядро которого совпадает с центром m) следующим образом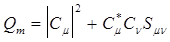 (11)
(11) (12),
(12), (13)
(13) , (14)
, (14) (15)
(15) (16)
(16) (17)
(17) (18)
(18)


