|
|
Бланк графического отчёта по практическому занятию(рисунки в альбоме)
Информационный блок
Синаптогенез. Образование синапсов первично происходит в эмбриональном периоде, во время развития нервной ткани и вторично в постэмбриональном периоде, проявляясь в виде пластичности, а также при патологических процессах в нервной ткани. В эмбриональном периоде по мере дифференцировки нейробласта в нейрон, в медиаторном периоде у юных нейронов появляются первые пузырьки с медиатором, затем развитие органелл синтеза и секреции (грЭПС, КГ), накопление медиаторов, поступление их в аксон, образование синапсов.
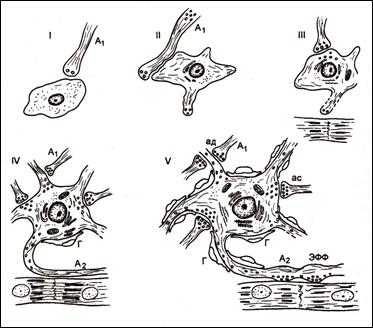
Рис.1. Стадии дифференцировки эфферентного нейрона внутри-сердечного ганглия человека (по В.Н.Швалёву). I – нейробласт; II – нейробласт с формирующимися дендритами, III – юный нейрон с форми-рующимися синаптическими пу-зырьками и синапсами; IV – дифференцирующийся нейрон с растущим аксоном; V – зрелый нейрон с многочисленными си-напсами и сформированном нервно-мышечным окончанием на кардиомиоцитах; А1 – преганглионарные волокна; ЭФФ – эфферентное нервно-мышечное окончание; ас – аксосоматические синапсы; ад – аксодендритические синапсы; Г – глиоциты.
Пластичность в постэмбриональном периоде выражается в появлении новых терминалей (аксональное почкование) и появлении новых синапсов (синаптическое замещение), в их модификации, увеличении или уменьшении числа синапсов. Проявляется наиболее сильно в первые годы после рож-дения, при изменениях гормонального фона, обучении новым навыкам и др. При повреждениях мозга проявляется в неполном восстановлении функций.
Строение синапса.
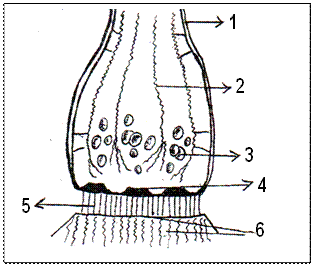
Рис. 2. Схема ультраструктуры синап-сов мозга. 1 – аксолемма; 2 – цитоске-летные нити; 3 – синаптические пу-зырьки; 4 – утолщение пресинап-тической мембраны; 5 – синаптичес-кая щель и внутрисинаптические нити; 6 – постсинаптическая мембрана и утолщение.
Синаптическая передача.
Механизм – каскад событий: 1) синтез одного или нескольких нейромедиаторов в перикарионе; 2) его транспорт в синаптическую терминаль; 3) накопление в виде пузырьков (в пузырьке несколько тысяч молекул = квант) вместе с АТФ и катионами. Величина кванта зависит от активности ферментов синтеза медиатора; 4) секреция нейромедиатора в виде слияния пузырька с пресинаптической мембраной и выделения кванта в щель; 5) взаимодействие медиатора с рецептором постсинаптической мембраны (шизофрения – увеличение количества рецепторов дофамина в постсинаптической части, депрессия сопровождается увеличением количества рецепторов к норадреналину и серотанину, лекарственные препараты - антидепрессанты уменьшают число рецепторов к этим медиаторам); 6) изменение мембранного потенциала постсинаптической мембраны (деполяризация при возбуждающем синапсе, или гиперполяризация при тормозном); 7) удаление нейромедиатора двумя способами: либо инактивацией ферментом (напр. ацетилхолинэстеразой, моноаминоксидазой), или захватом пресинаптической терминалью, при этом захват осуществляют специальные белки-транспортёры, дефекты их синтеза в терминалях – причина психических заболеваний (например: дефекты транспортёров захвата норадреналина и серотанина лежат в основе шизофрении и маниакально-депрессивных психозов). Также на этот механизм влияют антидепрессанты и наркотики кокаин, амфетамин и др.
Трансплантация.
При болезни Паркинсона дегенерация нейронов чёрной субстанции (недостаточная секреция медиатора дофамина) вызывает дефицит дофамина в области стриатума и нарушения в двигательных центрах. Проводится интрацеребральная трансплантация содержащих дофамин клеток при неэффективности фармакотерапии.
Повреждение синапсов.
Патология мозга, вызванная инфекционным процессом, интоксикациями, травмами, кровоизлияниями, нарушение кровообращения приводят к ишемии нервной ткани. Морфологические изменения нейронов после повреждения: 1) дис-трофические обратимые, 2) некробиотические (необратимые), 3) компенсаторно-восстановительные. Структурные изменения в синапсах нейронов коры наступают через 30 минут, наиболее повреждаются синапсы находящиеся в состоянии функциональной активности в момент повреждения. В основе повреждения синапсов при ишемии лежит снижение содержания макроэргических соединений, нарушение ионного гомеостаза, образование свободных радикалов, активация перикисного окисления липидов, приводящая к повреждению синаптических мембран и ионных насосов. В первые минуты про-исходит дестабилизация синаптической мембраны, её «аноксическая» деполяри-зация, приводящая к резкому притоку в цитозоль ионов кальция из внеклеточной среды, конформация белковых проекций, отёк синаптической терминали и Са-зависимое выделение нейромедиатора в синаптическую щель с воздействием на постсинаптическую часть. Последующие изменения в синапсах определяются нейромедиаторной специфичностью и типом организации постсинаптических рецепторов. Выделяют глутаматэргические синапсы, имеющие в постсинаптической части рецепторы, сопряжённые с кальций-зависимыми каналами, подобными NMDA – рецепторам возбуждающих аминокислот и неаминокислотные пептидергические (ГАМК, серотонин, пептиды). Выделяют два типа токсического повреждения аминокислотными медиаторами: быстрый, с развитием острого отёка и набухания синапса в результате патологического перераспределения ионов и воды, в результате открытия ионных каналов (развивается в первые минуты) и второго медленного, с повышением концентрации свободных ионов кальция в перикарионе, которые активируют биохимические процессы, приводящие к гибели синапсов и нейрона в целом. Острые гидропические (отёк и набухание) изменения при быстром типе распространены и характерны для всех видов синапсов и нейронов, почти всегда обратимы. Первая (гидропическая) фаза повреждения длится 10 – 20 минут, возможно её прерывание введением препаратов антагонистов NMDA – рецепторов. Во второй фазе увеличивается приток из внеклеточной среды ионов кальция и в перикарионе активируются кальций-зависимые гидроолитические ферменты, повреждающие митохондрии, клеточную мембрану. Активация ферментов приводит к нарушению пресинаптической решётки, изменениям филаментозных белков системы субсинаптических единиц, нарушает их связь с синаптическими мембранами, блокируется передача нервного импульса, это является ведущим в повреждении синапса. Чем сильнее повреждение филамент, тем меньше возможность последующего восстановления синапсов. В первые трое суток в нейропиле выявляются синапсы с повреждениями по светлому и очаговому типам. В них явления набухания, просветления цито-плазмы, нарушение распределения синаптических пузырьков, появляются осмиофильные нити, крупные вакуоли. Число синаптических пузырьков резко уменьшается, часть их агглютинируется. В области деструкции цитоплазма становится электронно-прозрачной, синаптическая мембрана искривляется. В нейропиле коры увеличивается плотность плоских контактов. В дальнейшем увеличивается число положительно искривлённых синапсов. Патологические изменения развиваются по гидропическому типу, выявляются в течении 30 суток после острой ишемии (необратимы). Параллельно идёт элиминация разрушенных синапсов, в неповреждённых синапсах происходит гипертрофия и компенсаторно-восстановительное образование новых контактов (рис.3, 4, 5). Механизмы медленного типа более отдалённые по срокам (через 30 – 60 минут) и свойственны только определённым нейронам – пирамидным клеткам гиппокампа, таламуса, зубчатой фасции, париетальной коры. В коре больших полушарий кроме синапсов аминокислотного типа имеется много синапсов использующих другие медиаторы: ГАМК, серотанин, норадреналин, ацетилхолин, гистамин и другие нейропептиды. Основное их отличие – отсутствие в составе постсинаптической мембраны рецепторов, сопряжённых с кальциевыми каналами. Это существенно влияет на степень повреждаемости таких синапсов при ишемии. Токсические повреждения менее выражены, а в ГАМК-ергическиех синапсах вообще не выражены.
Рис. 3.Электронная микрофотография. Гипертрофия пресинаптической части, шипикового аппарата, увеличение активной зоны контакта множественного перфорированного аксо-шипикового синапса. Первые сутки постишемического периода. Кора больших полушарий. Слой I. Ув. 59000. СТ – синаптическая терминаль, СП – синаптические пузырьки, М – митохондрия, ША – шипиковый аппарат, (↓) – Деструктивные изменения синапсов после асфиксии мозга
Рис №4. Электронная микрофотография. Простой перфорированный аксо-дендритический синапс. Кора большого мозга крысы, слой I. Спустя 6 часов постишемического периода (асфиксия). Ув. 44 000. Значительное просветление цитоплазмы терминали аксона, уменьшение числа синаптических пузырьков и их склеивание (агглютинация) , появление нитевидного материала и вакуолей в пресинаптической части. СТ – синаптическая терминаль, СП– синаптические пузырьки, Д – дендрит.
Рис. №5. Простой перфорированный аксо-шипиковый синапс с двумя активными зонами. Кора большого мозга крысы, слой I. Спустя 6 часов постишемического периода (асфиксия). Ув. 52 000. Синаптическая терминаль содержит СП – синаптические пузырьки, показан шипик и стрелками (↓) активная зона контакта.
Репаративные процессы в синапсах.
Восстановление нейронов идёт через: усиление синтеза белка, репарацию повреждённых тел и синапсов, сильную реакцию глии, регенерацию кровеносных сосудов, внутриклеточную гиперплазию и пролиферацию, гипертрофию сохранившихся синапсов, образование новых синапсов. Наиболее пластичны апикальные дендриты пирамидных нейронов и синапсы дендритного дерева. На 10 – 30 минуты после повреждения синапса, начинается восстановление ионного гомеостаза путём включения ионных насосов, выхода воды из синапса, восстановления потенциала покоя мембраны, инактивация или обратный захват нейромедиатора. Эти процессы происходят только в части синапсов и зависят от выраженности предшествующей быстрой фазы повреждения (гидропического отёка и накопления кальция). Репаративные процессы в синапсах проявляются через два механизма: реорганизацию имеющихся синапсов и образование новых контактов (неосинаптогенез). Механизмы реорганизации синапса. Компенсаторно-восстановительные процессы более полно проявляются спустя 90 минут после ишемии. Ранние признаки: а) увеличение положительно искривлённых контактов, б) созревание сохранившихся контактов, в) накопление крупных и очень крупных контактов, г) возрастает число гипертрофированных синапсов, д) расщепление на автономные синапсы. В 1 сутки начинается расщепление системы субсинаптических единиц, затем расщепление терминали и постсинаптической зоны. Вначале из простого синапса образуется смешанный (имеющий зрелый участок системы субсинаптических единиц с плотными проекциями и незрелый десмосомоподобного типа). Затем незрелый участок приобретает плотные проекции и гипертрофируется. При его гипертрофии до 600-700 нм (≈ Через 3 суток) происходит инвагинация си-наптической мембраны и последующее его расщепление на простые и мно-жественные перфорированные синапсы, диаметром 200-300 нм, с тремя или четырьмя активными зонами контакта рис. Биологический смысл расщепления в достижении оптимального функционирования автономных зон экзоцитоза синаптических пузырьков, повышение площади контактирующих нейронов, увеличение эффективности каналов передачи информации, вытеснение повреждённых нейронов из рабочего поля.
Неосинаптогенез. Кроме механизмов реорганизации синапсов, с 7 суток активируются механизмы образования новых незрелых синапсов с последующим их созреванием (рис.1). Начальной фазой образования синапсов является формирование постсинаптического уплотнения и десмосомоподобного контакта, затем происходит увеличение объёма синаптической части и синтез филаментозного материала, появляются синаптические пузырьки и плотные проекции. Происходит реорганизация контактов путём гипертрофии и расщепления. Выделяют различные варианты образования синапсов в постишемическом периоде (рис.2). Десмосомоподобные контакты диффузно распределяются в нейропиле, могут формироваться вблизи зрелого контакта на этой же терминали или на вновь образованном отростке нейрона. Наиболее пластичны апикальные дендриты пирамидных нейронов. Дендритное дерево восстанавливается за счёт роста сохранившихся дендритов в длину, из разветвления и образования новых шипиков. Даже в условиях значительного повреждения синапсов и отростков, в процессе взаимодействия нейроны сохраняют исходную общую площадь контактов, стремятся как можно быстрее восстановить исходный объём (например: через 7 суток периода асфиксии в 1 слое коры восстанавливается площадь контактов до исходного уровня за счет гипертрофии сохранившихся и образования новых). Скорость восстановления зависит от вида повреждения, например: при асфиксии - через 7 суток, при ишемии вызванной кровопотерей - через 30 суток. Также, на скорость неосинаптогенеза влияет послойная функциональная специализация ткани мозга. Например, лучше всего восстанавливаются синапсы I, V, VI слоев коры и больше всего происходит редукция функционально активных зрелых синапсов нейронов III и IV слоёв.
Зарисовать в альбоме схемы №1, №2.
Рис.№1 Схема механизмов реорганизации межнейронных синапсов в коре больших полушарий в постишемическом периоде. 1 – 2 – образование зрелых синапсов из функционально незрелых контактов; 3 – 11 – образование зрелых синапсов путём гипертрофии и расщепления; 3 – 5 – гипертрофия синапсов; 6 – 8 – расщепление пресинаптической части; 9 – 11 – расщепление постсинаптической части.
Рис.№2 Различные варианты образования ассиметричных синапсов при ишемии и в постишемическом периоде. А - одновременное появление плотных проекций пресинаптической решётки и синаптических пузырьков; Б – первоначально появление синаптических пузырьков; В– первоначальное появление парамембранных скоплений филаментов и образование симметричного контакта. Дегенерация нервных волокон (Уоллеровская) и регенерация.
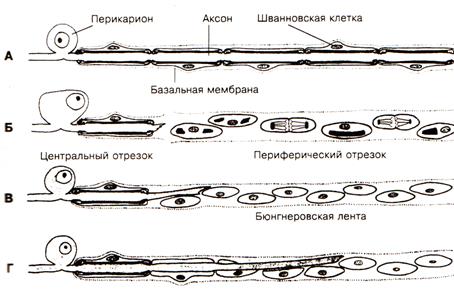
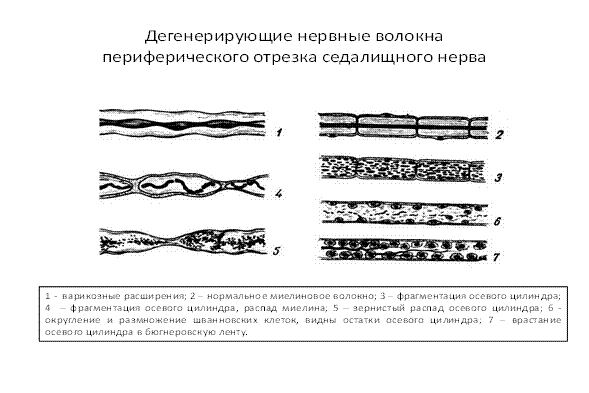
При повреждении нервного волокна происходят следующие изменения (рис.4): в центральном отрезке, связанным с перикарионом, сначала осевой цилиндр разрушается, происходит его фрагментация, демиелинизация и зернистый распад миелина, фрагменты поглощаются макрофагами (рис. 5,6,7). Через 3 дня в центральном отрезке появляется аксонный транспорт, обеспечивающий его регенерацию. Ретроградный аксонный транспорт – эффективное средство выживания нейронов. Глия начинает размножаться и образовывать ленты Бюгнера – цепоч-ки, по которым пойдёт рост и восстановление осевого цилиндра (рис. 3, 4). Шванновские клетки выделяют стимуляторы роста аксона – нейротрофические факторы. В теле нейрона наблюдаются набухание и тигролиз. На конце центрального отростка образуется конус роста - булавовидное утолщение (ламеллоподия), от которого отходят тонкие пальцевидные отростки – филоподии. Конус роста осуществляет направленный рост аксонов. Филоподии растут в различных направлениях и исследуют потенциальное пространство вокруг аксона. Существуют теории направленного роста: а) теория о хемотропизме (Кахаля), рост аксона по градиенту концентрации химических факторов, выделяемых мишенями. In vitro исследованы градиенты фактора роста нервов (NGF) и ацетилхолина, они влияют на направление роста аксонов; б) теория «меченых путей»:по мере своего роста пионерский аксон (посредством молекул узнавания – адгезии) последовательно считывает молекулярные метки в межклеточном пространстве или на поверхности клеток и растёт в нужном направлении.За первым аксоном вслед растут отростки других аксонов, образуя тракты (в ЦНС) и нервы на периферии. Молекулы адгезии: а) мембранные (нейромодулин, нейрофизин), встроены в ламелло- и филоподии аксона, взаимодействуют с комплементарными молекулами в пространстве роста и обеспечивают фиксацию конуса роста на поверхности мишени (например, фиксацию аксона мотонейрона на участке скелетного волокна при регенерации мышцы, регенерации нейро-мышечного окончания), короткий растущий отросток нейрона накапливающий нейромодулин (GAP–43), впоследствии становится аксоном; б) молекулы внеклеточного матрикса (ламинин, фибронектин, коллаген), ламинин при исследовании In vitro влияет на рост аксонов, прикрепление конуса роста к субстрату. В переферическом отростке аксон полностью дегенерирует, а клетки глии пролиферируют и формируют «ленту Бюгнера» - цепочку шванновских клеток, направляющую рост аксона, они продуцируют ФРН и выставляют на поверхности его рецепторы. Если филоподии находят периферический отросток, они прорастают в периферическую ленту Бюгнера, конус роста аксона перемещается по поверхности шванновских клеток, отслаивет покрывающую их мембрану и блокирует дальнейший синтез ФРН, происходит восстановление нервного волокна (рис.3, 4). Восстановление связей может происходить за счёт образования коллатеральных ветвей наз. «спраутинг» из области узловых перехватов от окружающих непов-реждённых волокон. Скорость роста аксона 0,25 мм/ сут, а после прохождения зоны травмы – 3 -4 мм/ сут.
Рис. 3. Взаимоотношения между шванновскими клетками и регенерирующим аксоном. А – здоровое волокно; Б – после перерезки, в периферическом отрезке шванновские клетки пролиферируют и начинают выделять нейротрофические факторы; В – регенерация центрального отростка и его врастание в ленту бюгнера; Г – дальнейший рост аксона, отслаивание клеточной мембраны, контакт со шванновскими клетками, блокирование выделения шванновскими клетками фактора роста нервов, восстановление волокна.
Таблица, образец рисунка для зарисовки в альбоме Рис.4
Рис.5
Рис.6
Таблицы, рисунки в альбоме Рис.7
Рис.8 Ампутационная невромаформируется тогда, когда между перерезанными отрезками нерва прорастает соединительная ткань. «Потерянные» отростки беспорядочно хаотично разрастаются образуя опухоль – неврому (рис.9).
Рис. 9. Внутриствольная неврома.
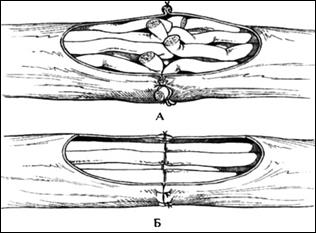
Для предупреждения её формирования центральный и периферический отрезки нерва максимально сближают и сшивают отдельные пучки (смотри рисунки 10, 11).
Также используют воздействие на область повреждения антимитотическими веществами – цитостатиками, тормозящими образование рубцовой ткани. И нейротрофическими препаратами – для стимуляции регенерации.
Рис. 10. Техника при соединении пери-ферических нервов. А – соединение эпиневральной оболочки, Б – соединение отдельных нервных пучков.
Рис.11. Репаративная тубулизация.
Миелинизация.
В организме протекает асинхронно, процесс долгий и не завершается к моменту рождения. Скорость миелинизации разных отделов разная. Происходит при помощи тонких отростков олигодендроцитов, они контактируют с отростками нейронов (рис.1). В ЦНС один олигодендроцит миелинизирует сразу несколько нервных отростков, а на периферии одна шванновская клетка миелинизирует только один. Окраска на миелин: осмий, ТЭМ, фазово-контрастная микроскопия (рис.3). Рис. 1.
Демиелинизация.
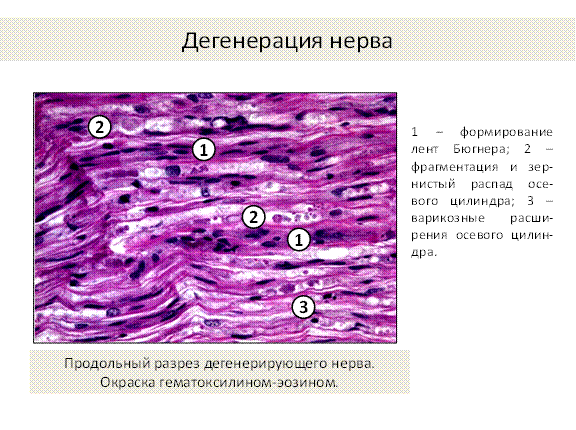
Происходит при мутации генов, кодирующих белки миелина и щелевых контактов, а также при повреждении волокна: травмы, инфекции, гипоксия, склероз и другие патологические состояния и болезни. Миелин чувствителен к разным неблагоприятным факторам: а) ишемия; б) гипертермия; в) инфекции. Они вызывают его расслоение и распад, что ведёт к замедлению нервной передачи. В осевом цилиндре при этом происходит разволокнение нейрофибриллярного аппарата, варикозные расширения, он фрагментируется и подвергается зернистому распаду (рис.2). Например, множественный склероз – наследственное демиелинизирующее заболевание, проявляется в виде склеротических бляшек в головном и спинном мозге, начинается рано, у молодых, приводит к параличам, парезам, нарушению речи, зрения и др. Энцефалиты – воспалительные инфекционные заболевания. Диабетическая нейропатия – накопление сорбитола в шванновских клетках с последующим их повреждением – замедление скорости нервной проводимости – сегментация, демиелинизация и деградация аксонов. Полиневропатии – дефицит витамина В 12, влияет на нервы периферии, мозжечка, спинного мозга. При болезни Альцгеймера происходит отложение амилоидного фибриллярного белка внутри и вне нейронов, аномалия синтеза микротрубочек приводит к формированию фибриллярных клубков, дегенерации нейронов, их отростков, синапсов.
Рис. 2.
Рис.3
Тестовые вопросы Миелиновая оболочка нервных волокон образована … § цитоплазматической мембраной (нейролеммой) § белками, транспортируемыми из перикарионов § отростками астроцитов § эндоневрием В аксоне нервной клетки отсутствуют… § митохондрии § микротрубочки § везикулы § хроматофильное вещество Функция осевого цилиндра нервного волокна … § проведение нервного импульса. § обеспечение цитоплазматического тока. § генерация нервного импульса. § перемещение нейроцита.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|