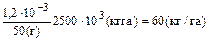|
|
Щелочность и кислотность почв
По формам проявления кислотных и щелочных свойств почв принято различать актуальную и потенциальную кислотность и щелочность. Актуальные кислотность и щелочность характеризуются концентрацией ионов водорода и гидроксила в почвенном растворе. Степень кислотности и щелочности почвенных растворов, вытяжек и суспензий оценивают величиной рН. Количественно кислотность и щелочность определяют по содержанию титруемых, соответственно, щелочами (обычно NaOH) или кислотами (НС1) веществ, обладающих кислыми или щелочными свойствами. На практике чаще измеряют рН водной вытяжки или водной суспензии, а не рН почвенных растворов. Кислотность почвенных растворов связана с присутствием в почвах свободных органических (главным образом гумусовых) и неорганических (преимущественно угольной) кислот и других органических и минеральных соединений, способных оказывать влияние на кислотно-основное равновесие в почвенных растворах. Среди таких органических компонентов почв следует назвать соединения, содержащие фенольные ОН-группы, а среди минеральных компонентов – соединения, содержащие катионы А13+ и Fe3+, кислотные свойства которых соизмеримы с кислотными свойствами таких кислот, как угольная и уксусная. В водных растворах, как известно, произведение констант основности и кислотности соответствующих кислотно-основных пар равно ионному произведению воды. Ионное произведение чистой воды меняется при атмосферном давлении от 0,1139 • 10–14 (0°С) до 9,614 • 10–14 (60°С), а около 25°С имеет значение 1,008 • 10–14. Поэтому для почвенных растворов обычно принимают: КаКb=10–14 или рКа + рКb= 14, (10) где Каи Кb – константы кислотности и основности соответственно; рКаи рКb – отрицательные логарифмы соответствующих констант. Для наиболее характерных сопряженных кислотно-основных пар, встречающихся в почве, кислотность и основность характеризуются следующими значениями рКа и рКb(по Л. А. Воробьевой):
Сравнение значений констант основности соответствующих кислотно-основных пар показывает, что наиболее сильными основными свойствами в почвах обладают ионы S2–, PO Определенного вклада в щелочность следует ожидать и от ионов H3SiO
где аН+ – активность ионов водорода в растворе; Рсо2 – парциальное давление СО2; К1и К2– константы диссоциации угольной кислоты по первой и второй ступеням соответственно; КГ(СО2) – константа Генри для диоксида углерода; gСа2+ и ghco ПРСаСО3– произведение растворимости карбоната кальция. В случае, когда почвенные воды находятся в равновесии с атмосферным воздухом и кальцитом, рН раствора составит около 8,3. Присутствие магнезита MgCO3 может увеличить рН до 10,0 -11,0. В случае отсутствия карбонатов кальция и магния в почве и увеличения концентрации диоксида углерода в почвенном воздухе рН раствора снижается и при содержании СО2, равном 5 -10 % (об.), может упасть примерно до 4. Потенциальные кислотность и щелочность почв проявляются в результате различных воздействий на почву. В настоящее время понятие потенциальной кислотности почв разработано значительно более подробно, чем понятие потенциальной щелочности, сведений о которой недостаточно. Потенциальную кислотностьпочв принято определять при воздействии на почву растворов хлорида калия (обычно 1 н. раствор КС1) – обменная кислотность – или растворов гидролитически щелочной соли (обычно 1 н. раствор CH3COONa) – гидролитическая кислотность. Обменную кислотность оценивают по величине рН солевой вытяжки. Для количественного определения кислотности солевую вытяжку титруют раствором щелочи. В случае обработки почвы раствором КСl возможны следующие реакции обмена катионов почвенно-поглощающего комплекса: ППК-Н+ + КСl ® ППК-К+ + НСl; (12) ППК-А13+ + 3КСl ® ППК-К В дальнейшем, при титровании солевой вытяжки раствором NaOH, в реакцию вступают НС1 и А1С13: HCl + NaOH ® NaCl + Н2О; (14) AlCl3 + 3NaOH ® 3NaCl + А1(ОН)3. (15) Ионы А13+, выделенные из почвенно-поглощающего комплекса в раствор, оказывают влияние на степень кислотности, поскольку в водных фазах образуются ионы A1(OH) Процесс ионного обмена, протекающий при обработке почвы раствором CH3COONa, можно представить уравнением: ППК-Н++ CH3COONa ® ППK-Na+ +CH3COOH. (16) Уксусная кислота, образующаяся в этом случае, как известно, значительно слабее, чем соляная, выделяющаяся при обработке почв растворами КСl. Поэтому процесс обмена по реакции (16) протекает более глубоко, чем по реакции (12), и величина гидролитической кислотности всегда выше, чем величина обменной кислотности. Значения рН водной вытяжки после обработки почвы 1 н. раствором CH3COONa обычно находятся в интервале 6,2 - 7,5 в отличие от рН 3,0 - 6,5, характерного для случая обработки почв раствором КС1. Интервал рН 6,2-5-7,5 соответствует области минимальной растворимости А1(ОН)3, поэтому, хотя А13+ и оказывает влияние на величину гидролитической кислотности и участвует в обмене катионов, в водной вытяжке, полученной при обработке почв раствором CH3COONa, соединений алюминия практически нет. Изучение природы потенциальной кислотности почв, как отмечал в своих работах Д. С. Орлов, имеет не только важное теоретическое или познавательное значение, но от решения этого вопроса зависит и правильный выбор приемов борьбы с почвенной кислотностью. Как показали экспериментальные исследования, для почв характерен самопроизвольный переход от насыщения катионами Н+ к насыщению А13+. Так, любые почвы тем или иным способом можно насытить катионами Н+ и перевести их в состояние, когда в составе обменных катионов будут преобладать катионы водорода, однако со временем в такой почве в составе обменных катионов появятся катионы А13+, количество которых постепенно будет увеличиваться. Д. С. Орлов объясняет этот процесс на примере трансформации кристаллической решетки каолинита следующим образом: на сколе кристалла каолинита образуются избыточные отрицательные заряды, удерживающие обменные катионы. При обработке таких кристаллов растворами кислот происходит обмен катионов металлов на ионы Н+. Однако, поскольку катионы Н+ имеют значительно меньшие размеры, чем катионы металлов, они способны мигрировать во внутренние слои решетки. В дальнейшем они способны вступать во взаимодействие с ОН-группами и образовывать молекулы воды или новые ОН-группы, соединяясь с атомами кислорода. В результате таких преобразований ион А13+, занимавший центральное место в алюмогидроксильном октаэдре, превращается в ион A1(OH)
Примеры решения задач Пример 17. Для почвы с буферной емкостью БЕ = 22 ммоль Н+/(кг • рН) рассчитайте буферную емкость в кг Н+/(га- рН), полагая, что масса 1 га почвы равна 2500 т. Если почва первоначально имела pH1 5,0, определите рН почвы после поступления ионов Н+ из атмосферы и продуцирования их в почве в количестве до 3,5 кг Н+/(га • год) в течение 10 лет (рН2) и последующего внесения 3,2 т/га порошка известняка, нейтрализующая способность которого составляет 80% таковой СаСО3 (рН3). Решение. Решение задачи сводится к пересчету с учетом изменения размерности буферной емкости (БЕ): БЕ = К•БЕ*; БЕ* = 22 • 10–3 где Мпочв – масса почвенного слоя на 1га, кг; Мн – молярная масса атомов водорода, г/моль; БЕ* = 22 · 10–3 · 2500 · 103 · 10–3 = 55 [кгН+/(га · рН)]. Определение рН почвы основывается на уравнении баланса с учетом продуцирования и поступления ионов водорода из различных источников. Количество поступивших в почву ионов водорода (Мн+) в соответствии с условием задачи должно быть равно: МН+ = БЕ · (pH1 – рН2). Отсюда можно получить значение рН2: рН 2= рН2 = На этой стадии внесение 3,2 т СаСО3 на 1 га почвы приводит к повышению рН почвы до рН3: mCaCOзW = БЕ · К(рН3 – рН2) где К – коэффициент, учитывающий величину заряда иона кальция, а также пересчет буферной емкости по водороду на карбонат кальция; W –учитывает реальную нейтрализующую способность карбоната кальция – 80%. Отсюда получаем: рН3 = Ответ: БЕ = 55 кг Н+/(га · рН); рН2 = 4,4; рН3 = 5,3. Пример 18. Потребность в извести почвы с рН 5,2, предназначенной для производства сельскохозяйственных культур, равна 8 т СаСО3/га. Рассчитайте, сколько времени должно было бы пройти после внесения этого количества извести до его следующего внесения, если предположить, что фермер позволил рН снизиться до 6,0. Примите, что после внесения в почву карбоната кальция значение рН должно достичь 6,7. Известно, что ежегодное поступление ионов водорода в почву составляет: в результате дыхания – 4,4, нитрификации – 2,0, поглощения питательных веществ – 0,7 и атмосферных поступлений – 1,3 кг Н+/(га · год). Решение. В основе решения задачи лежит представление о существовании диапазона концентраций ионов водорода (рН), оптимальных для развития сельскохозяйственных растений. Примем для решаемой задачи оптимальную величину рН, равную 6,7. Тогда потребность СаСО3 = БЕ · DрН, где БЕ – буферная емкость; DрН – изменение рН. БЕ = В соответствии с условием задачи определим необходимое количество СаСО3 для доведения рН почвы до 6: потребность СаСО3 (рН 6) = 5,3 · (6 – 5,2) = 4,2 (т СаСО3/га). Таким образом, оставшаяся часть СаСО3 [mост = 8 – 4,2 = 3,8 (т)] идет на взаимодействие с поступающими из различных источников ионами водорода по уравнению: СаСО3 + 2Н+ ® Са2+ + Н2О + СО2 Количество молей СаСО3 и Н+ составит:
где МСаСОз – молярная масса карбоната кальция, равная 100 кг/кмоль. Сумма всех поступлений ионов водорода в почву nH+ равна:
Поскольку реагенты вступают в реакцию в стехиометрическом соотношении СаСО3:Н+ = 1:2, с учетом материального баланса искомое выражение для определения времени можно записать следующим образом:
где t– времядо следующего внесения в почву СаСО3;
Ответ: до следующего внесения извести в почву должно пройти 9 лет.
Соединения азота в почве
Основное количество соединений азота сосредоточено в верхнем почвенном горизонте и представлено главным образом органическими соединениями. В среднем на долю азота приходится около 5% от массы органического вещества почвы, что составляет обычно 0,02-0,4% от массы пахотного слоя почв. Помимо органических соединений (гумусовые вещества и растительные остатки), азот в почве присутствует в виде неорганических компонентов в почвенном воздухе, почвенном растворе и в обменном или фиксированном состоянии входит в состав твердой фазы почв. Среди органических соединений азота от 20 до 50% составляют аминокислоты, присутствуют также амиды, аминосахара и гетероциклические соединения. Около 50% органических соединений азота остаются неидентифицированными. Все органические соединения азота можно разделить на легко разлагаемую и стабильную фракции. На долю первой приходится обычно менее одной трети всего органического азота почвы. Органические соединения азота, содержащиеся в почве, являются основным резервом для питания растений. В результате процессов химической и, преимущественно, биохимической трансформации этих соединений происходит образование доступных для растений веществ, протекает так называемый процесс мобилизации азота. Даже бедные почвы, например дерново-подзолистые, содержат в пахотном слое до 4 г/гаазота. Этого количества при его полной мобилизации было бы достаточно для созревания урожая в течение 50-60 лет. Однако такая мобилизация азота привела бы к полному разрушению гумусовых веществ, и почвы утратили бы все свои агрономически ценные свойства. Соединения азота всегда содержатся в поступающих в почву растительных остатках и мобилизуются в процессе их разложения. Особенно интенсивно этот процесс протекает на ранних стадиях распада растительных остатков, когда соотношение массы углерода и азота в них ниже 20. В дальнейшем скорость поступления соединений азота определяется скоростью разложения органического вещества почвы. Обычно в полевых условиях в результате процессов разложения в почву ежегодно переходит от 1 до 3% азота, содержащегося в органическом веществепочв. В почвенном воздухе соединения азота представлены молекулярным азотом, аммиаком, гемиоксидом, оксидом и диоксидом азота. При газовом обмене с атмосферным воздухом часть почвенного азота теряется. Так, по данным Б. Н. Макарова, например на дерново-подзолистых и суглинистых почвах, в среднем за период с мая по август на полях без внесения азотных удобрений теряется только в виде NO2 до 0,2 т азота на каждом гектаре. Внесение азотных удобрений увеличивает количество соединений азота, поступающих в атмосферу, что особенно заметно в первый год. В целом, если принять во внимание данные о возможном переходе 27% азота из удобрений в газовую фазу и считать доли молекулярного азота и N2O в газовой фазе одинаковыми, при внесении 90 кг азота на гектар почв в атмосферу может выделиться 12 кг N2, 19 кг N2O и 0,8 кг NO2. Экспериментальные измерения состава приземного воздуха, проведенные Б. Н. Макаровым, показали, что в зависимости от гидротермических условий содержание диоксида азота в приземном слое колеблется от 0 до 8 · 10–7 %(об.) и в среднем составляет 4 · 10–7 %(об.), доля аммиака изменяется от 0 до 9 · 10–6 %(об.). Главными источниками образования газообразных соединений азота в почве являются протекающие при участии микроорганизмов процессы аммонификации, нитрификации и денитрификации. Аммонификация – это процесс разложения органических веществ, протекающий с участием специфических аммонифицирующих микроорганизмов. В результате этого процесса в почвенном воздухе появляется газообразный аммиак, а в почвенном растворе – ионы аммония. Ионы аммония вступают во взаимодействие с почвеннопоглощающим комплексом, причем часть ионов NH Процесс фиксации ионов аммония можно рассмотреть на примере связывания ионов аммония минералом иллитом. Расположенные на внешней поверхности кристалла и его сколах ионы NH Неорганические соединения азота присутствуют в почве в виде NH Окисление аммиака микроорганизмами протекает в два этапа. На первом этапе под воздействием бактерий Nitromonas происходит окисление ионов NH В процессе нитрификации в почву поступают ионы водорода: NH Поэтому процессы нитрификации сопровождаются закислением почв, и при длительном применении аммонийных удобрений необходимо предусматривать компенсирующее известкование почв. При рН 7, Т = 25°С и достаточной аэрации почвы, когда окислительно-восстановительный потенциал почвенного раствора составляет 0,4-0,5 В, скорость нитрификации аммония может достигать 10-20 кг/(га · сут). Если аэрация почв затруднена и окислительно-восстановительный потенциал ниже 0,35 В, нитрификация может прекратиться, и в почве начнутся процессы денитрификации. Денитрификация – процесс восстановления, в результате которого происходит образование газообразных соединений азота, выделяющихся в атмосферу. Различают два пути денитрификации: косвенный, или химический, и прямой, или биологический. Косвенный процесс денитрификации связан с протеканием химических реакций: R-NH2 + HNO2 ® R-ОН + N2 + Н2О (18) (NH2)2CO + 2HNO2 ® 2N2 + СО2 + 3Н2О (19) 2HNO3 3HNO2 где R – органические радикалы. Разложение азотной и азотистой кислот следует отнести к основным процессам косвенной денитрификации в кислых почвах при рН < 5,5. Для таких почв отмечалось заметное увеличение содержания диоксида азота в почвенном воздухе, что укалывает на преимущественное протекание процесса разложения ионов NO Различают два типа процессов биохимической денитрификации: специфическую, или диссимиляторную, и неспецифическую денитрификацию. В процессе диссимиляторной денитрификации происходит восстановление нитратов до молекулярного азота в результате переноса электронов с субстрата (донора электронов) на нитраты, при этом высвобождается необходимая для микроорганизмов энергия. Неспецифическая денитрификация не выполняет энергетических функций. В этом процессе нитраты восстанавливаются преимущественно до нитритов. К неспецифической относят и ассимиляторную денитрификацию, при которой нитраты восстанавливаются до аммония. Неспецифическую денитрификацию часто рассматривают как первую стадию процесса денитрификации, при которой нитраты восстанавливаются до нитритов. Дальнейшее восстановление происходит в результате диссимиляторной денитрификации и протекает при участии микроорганизмов из родов Pseudomonos, Achromobacter, Micrococcus, Bacillus, Thiobacillus. Эти бактерии используют нитраты как источник энергии в отсутствие кислорода. Энергетический эффект этого процесса оценивается в 1760 кДж/моль. Суммарно процесс можно представить уравнением: С6Н12Об + 4NO Подавляющее большинство денитрифицирующих бактерий при высокой концентрации кислорода могут перейти на обычное дыхание. Поэтому процесс денитрификации протекает и в аэробных, и в анаэробных условиях. Однако наиболее интенсивно этот процесс протекает в плохо дренированных почвах при величине рН раствора, близкой к нейтральной, температуре около 25°С и окислительно-восстанови-тельном потенциале почвенного раствора Eh < 0,35В ( Необходимо отметить, что в процессе денитрификации часто происходит образование заметных количеств гемиоксида азота. Ежегодная эмиссия N2O из почв, по данным Д. С. Орлова, может достигать 20-50 г/га. Как известно, инертный в тропосфере, гемиоксид азота, достигая стратосферы, разлагается с образованием оксида азота, нарушающего нулевой цикл озона. Поэтому увеличение количества образующегося в почве гемиоксида азота, которое связано с ростом использования азотных удобрений, может оказать разрушающее влияние на озоновый слой планеты. Суммарно процесс трансформации неорганических соединений азота в почве можно представить схемой:

где k1, k2, k3, k4 – константы скоростей соответствующих реакций нитрификации и денитрификации; Г – сумма газов N2O. NO, NO2. N2. Скорости соответствующих реакций зависят от температуры почв, рН, степени аэрации и, следовательно, окислительно-восстановитель-ного потенциала почвенного раствора, содержания влаги, органических веществ и ингибиторов. Реакции нитрификации относятся к реакциям первого порядка, а реакции денитрификации имеют нулевой порядок, поэтому можно записать:
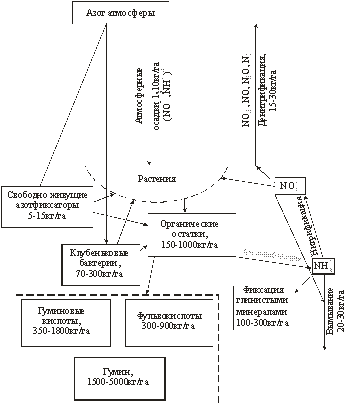
Для средних условий почв соответствующие константы скоростей реакций равны: k1 = 0,02 ч–1, k2 = 0,04 ч–1, k3= 0,015 мг · кг –1(N) · ч –1, k4 = 0,01 мг · кг–1(N) · ч–1. Константа скорости процесса окисления ионов NO Общие потери азота, удаляемого из почв в виде газообразных соединений, только с пахотных почв РФ составляют около 1,5 млн т азота в год. Для уменьшения потерь азота в некоторых случаях используют ингибиторы скорости процессов денитрификации. В качестве ингибиторов применяют такие соединения, как 2-хлор-6-трихлорметил-пиридин (торговое название N-serve) и 2-амино-4-хлор-6-метил-пиридин (торговая марка «Ам»). В общем виде литосферную ветвь глобального кругооборота азота можно представить схемой, предложенной Д. С. Орловым (рисунок 6). Природными источниками поступления соединений азота в почву являются соединения азота, присутствующие в атмосфере и поступающие с атмосферными осадками, азот атмосферы, фиксируемый бактериями, и азот, содержащийся в остатках живых организмов. К этим источникам все в больших количествах добавляются антропогенные поступления. Органические остатки живых организмов подвергаются гумификации и аммонификации. Ионы NH
Рис. 6. Схема литосферной части глобального кругооборота азота
Примеры решения задач Пример 19. Образец почвы был взят из верхнего горизонта влажной почвы. Из образца массой 50 г были экстрагированы 19-нитраты при помощи 200 мл 2 М КСl. Измеренная концентрация ионов NO Решение. В качестве первого шага определим количество нитратов (mNO mNO где Vэ – объем экстрагента, л; С NO mNO Далее пересчитаем взятый образец влажной почвы на абсолютную сухую почву. Исходим из следующей пропорции: 126 г влажной почвы содержит 100 г абс. сухой почвы 50 г влажной почвы содержит X г абс. сухой почвы. Таким образом, количество абсолютно сухой почвы в 50 г влажной почвы составит: X = В 1кг абс. сухой почвы будет содержаться ионов NO
= 30 (мг Примем, что объем почвенного раствора равен объему воды, присутствующей во влажной почве. Таким образом, концентрация нитратов в почвенном растворе (С С где ρ– плотность почвенного раствора, для упрощения в этой задаче принятая равной 1 кг/л;
Общее количество нитратов М М где Мпочв – масса почвы на площади 1га; mобр – масса навески почвы (50г); m М Ответ: в 1кг абс. сухой почвы содержится 30 мг NO

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 HS– + OH–
HS– + OH–
 + Н2О
+ Н2О  + OH–
+ OH–
 +Н2О
+Н2О  + OH–
+ OH–
 +Н2О
+Н2О  , (11)
, (11) + А1Сl3.(13)
+ А1Сl3.(13) и А1(ОН)2+.
и А1(ОН)2+. ,
,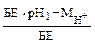
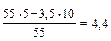
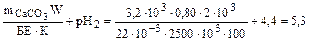
 [т СaCO3/(pH · га)]
[т СaCO3/(pH · га)] = 38(кмоль),
= 38(кмоль), = 8,4 [кмольН+/(га · год)].
= 8,4 [кмольН+/(га · год)]. ,
, = 9 (лет).
= 9 (лет). в результате такого взаимодействия может потерять подвижность. Обычно в почвах содержание связанного с ППК обменного аммония на порядок выше, чем свободного. Поэтому концентрация ионов NH
в результате такого взаимодействия может потерять подвижность. Обычно в почвах содержание связанного с ППК обменного аммония на порядок выше, чем свободного. Поэтому концентрация ионов NH 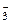 , лишь в некоторых щелочных почвах могут встречаться небольшие количества ионов NO
, лишь в некоторых щелочных почвах могут встречаться небольшие количества ионов NO 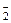 . Соотношение NH
. Соотношение NH  переходят в NO
переходят в NO  + 2O2® NO
+ 2O2® NO  < 5,9).
< 5,9).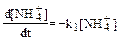 (24)
(24) (25)
(25) (26)
(26) (27)
(27)
 ), которое было экстрагировано:
), которое было экстрагировано: .
. .
. 0,030 (г
0,030 (г  /кг абс. сухой почвы) =
/кг абс. сухой почвы) = /кг абс. сухой почвы).
/кг абс. сухой почвы). ) составит:
) составит: =
=  ,
, .
. , содержащееся на 1 га почвы, может быть определено следующим образом:
, содержащееся на 1 га почвы, может быть определено следующим образом: =
=  ,
, – содержание нитратов в почве;
– содержание нитратов в почве;