
|
|
Катионообменная способность почв
Катионообменную способность почв относят к числу фундаментальных свойств почвы. Катионный обмен – это обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Реакцию обмена в общем виде можно представить следующим уравнением:
где М ППК – почвенно-поглощающий комплекс. Почвенно-поглощающий комплекс – материальный носитель катионообменной способности почв. Это понятие объединяет совокупность минеральных, органических и органоминеральных компонентов твердой фазы почв, обладающих ионнообменной способностью. Катионы, которые входят в состав почвенно-поглощающего комплекса и могут быть замещены в процессе ионного обмена, называют обменными катионами. Наиболее часто в реакции обмена принимают участие катионы Са2+, Mg2+, K+, Na+, H+, А13+. Одной из важнейших характеристик почвенно-поглощающего комплекса является емкость катионного обмена (ЕКО). В настоящее время различают стандартную, реальную и дифференциальную ЕКО. Стандартная ЕКО– общее количество катионов одного рода, удерживаемых почвой при стандартных условиях и способных к обмену на катионы взаимодействующего с почвой раствора. При определении стандартной ЕКО почву насыщают ионами Ва2+ из буферного раствора с рН 6,5. После насыщенияемкость определяют по количеству поглощенного почвой Ва2+ и выражают в смоль(р+)/кг (сантимолях положительных зарядов в 1 кг почвы). Реальную или эффективнуюЕКО определяют при обработке почвы небуферными растворами солей. О реальной емкости катионного обмена можно судить по сумме обменных катионов. Дифференциальную ЕКО характеризует приращение емкости катионного обмена с увеличением рН равновесного раствора: DЕКО/DрН. Для определения дифференциальной ЕКО почву насыщают катионами одного рода из буферных растворов с различными значениями рН (например, 6,5 и 8,2), а затем рассчитывают или общее приращение ЕКО, или ее приращение на единицу рН. Влияние рН на ЕКО особенно заметно для органической части почв, поскольку в нейтральной и кислой средахи реакциях обмена будет участвовать только водород карбоксильных групп, а в щелочной среде становится подвижным и водород фенольных ОН-групп. Величина ЕКО зависит от механического состава почв, преобладающей группы минералов и в первую очередь, от содержания гумусовых веществ в почвенно-поглощающем комплексе. Значение ЕКО меняется в широких пределах: от нуля(главным образом, для обломков кварца) до 500-900 смоль (р+)/кг (для гуминовых кислот). Поглощающая способность почв определяется илистой фракцией. Структурные элементы почв с размерами более 0,2-0,5 мм практически лишены способности к катионному обмену.
Обменные катионы почв
Состав обменных катионов почв является одним из важнейших показателей, используемых при диагностике и классификации почв. Так, например, в зависимости от содержания катионов Н+ и А13+ все почвы можно разделить на две группы: почвы, насыщенные основаниями (не содержат Н+ и А13+), и почвы, не насыщенные основаниями (содержат Н+ и А13+). Степень насыщения почв основаниями определяется по формуле: где V– степень насыщения почв основаниями в % от ЕКО; S – сумма концентраций обменных оснований (сумма концентраций катионов Са2+, Mg2+, Na+, K+); ЕКО – стандартная емкость катионного обмена. Почвы, не насыщенные основаниями, содержат некоторые количества обменных катионов Н+ и А13+, и для них всегда S < ЕКО. В эту группу почв входят подзолистые, дерново-подзолистые, болотные, серые и бурые лесные почвы, некоторые черноземы и почвы влажных субтропиков. Насыщенные основаниями почвы – это преимущественно степные почвы (черноземы, каштановые, сероземы, бурые и серо-бурые степные), а также почвы различных зон, сформированные при участии жестких грунтовых вод или на карбонатных породах. Среди этой группы следует выделитьпочвы, содержащие в значительных количествах обменный катион Na+. К ним относятся солонцеватые почвы, солонцы, многие солончаки. Повышенное содержание обменного катиона натрия в солонцах, например, приводит к появлению таких отрицательных свойств почв, как высокая щелочность, плотная слеживаемость в сухом состоянии, сильная трещиноватость почвенной корки, что вызывает разрыв корневой системы растений и гибель всходов; во влажном состоянии такие почвы отличаются плохими водно-физическими свойствами (вязкость, заплывание и липкость почвенной массы). Существуют три основные возможности засоления почвенной толщи: путем капиллярного поднятия солей с влагой снизу; поверхностными водами; первичное засоление, обусловленное морским генезисом почвообразующей породы. Первые два пути связаны с ошибками в сельскохозяйственном использовании земель, которые приводят к нарушению сложившихся в естественных условиях соотношений обменных катионов. Наибольшее влияние на состав обменных катионов в почвах, используемых для сельского хозяйства, оказывает внесение минеральных удобрений, орошение и осушение полей, поскольку эти агротехнические мероприятия способны вызвать изменение состава почвенных растворов. Помимо состава почвенного раствора на количественный и качественный состав обменных катионов значительное влияние оказывает природа почвенно-поглощающего комплекса (ППК). Почвы обладают различной способностью селективно поглощать катионы одного рода в ущерб катионам другого рода. Коэффициент селективности катионного обмена К, количественно характеризующий это явление, может быть определен по формуле: К = где М; и Mj – концентрации обменных катионов i-го и j-ro видов в ППК; Zi и Zj – их наряды; аi и aj – активности соответствующих катионов в равновесном растворе. Значение коэффициента селективности зависит от свойств катионов и химических особенностей компонентов ППК. В общем случае предпочтительнее связываются катионы с более высоким зарядом, а при равных зарядах – катионы с большей атомной массой. Таблица 8.Влияние продолжительности орошения на состав обменных катионов для темно-каштановой почвы (по Болдыреву, 1980)
*Орошение сильно минерализованными водами, в которых содержание Na+ составляет 78% суммы всех катионов в воде **Для слоя почвы 0 - 20 см.
Коэффициент селективности для пары обменных катионов, например Ca2+ - Na+, по данным различных авторов колеблется от –1 до 16. Однако, несмотря на способность почв преимущественно связывать катионы кальция, при орошении почв в них возможно накопление Na+. Это объясняется тем, что воды рек и водохранилищ, используемые для орошения в засушливых районах, содержат заметные количества натриевых солей. Доля Na+ в составе растворений солей по мере удаления по оросительным каналам от водохранилища постоянно повышается. При попадании в почву эти воды способны сместить установившееся равновесие в составе обменных катионов. Так, из таблицы 8 видно, что при орошении почв сильно минерализованнымиводами уже через 5 лет доля катионов Na+ в почвенно - поглощающем комплексе возросла более чем в два раза. Таблица 9. Оценка качества воды по опасности засоления и осолонцевания почв (по Ричардсу)
В качестве одной из характеристик природных и сточных вод, применяемых для орошения, принято использовать показатель адсорбируемости натрия (в англоязычном варианте - sodium adsorption ratio – SAR), который позволяет оценить опасность засоления и осолонцевания почв: SAR = 1,41 где [Na+], [Ca2+], [Mg2+] – концентрации соответствующих катионов в воде (мг-экв./л). Оценка опасности засоления и осолонцевания почв носит пока эмпирический характер и зависит от общей минерализации воды и величины SAR (таблица 9).
Примеры решения задач Пример 12. Представьте, что чистый гумус имеет 60 смоль карбоксильных групп на 1 кг, причем все они имеют рКд = 4,0. Рассчитайте долю групп, которые продиссоциируют при рН 3; 4; 5 и 6. Для продиссоциировавших фракций рассчитайте заряд, связанный с гумусом, при каждом значении рН. Решение.Карбоксильные группы диссоциируют по следующему уравнению:
В соответствии с этим уравнением константа диссоциации (Кд) определяется следующим соотношением:
где [RCOO–], [H+] и [RCOOH] – равновесные концентрации. Примем, что х – равновесная концентрация продиссоциировавших карбоксильных групп (х = [RCOO–). Тогда, в соответствии с химическим уравнением, выражение для Кд можно записать следующим образом:
откуда где C Как видно из полученной формулы, концентрация продиссоциировавших карбоксильных групп зависит от концентрации присутствующих в системе ионов водорода (рН). При рН 3, т. е. [Н+] = 10–3 М, концентрация [RCOО–] составит: [RCOO–]= Аналогичным образом рассчитываются концентрации [RCOO–] при других значениях рН. Доля продиссоциировавших карбоксильных групп (р3) при рН 3 есть отношение концентрации [RCOO–] к начальной концентрации карбоксильных групп:
Аналогичным образом определяются доли продиссоциировавших карбоксильных групп при рН 4; 5 и 6. Они равны р4= 0,50; р5 = 0,91; р6 = 0,99 соответственно. Поскольку заряд, связанный с гумусом, определяется карбокси-анионом, а общая величина заряда определяется его концентрацией, то искомый заряд, связанный с карбоксильными группами, при рН 3 равен 5,5 смользар/кг. При рН 4 заряд составит 30 смользар/кг, при рН 5 – 4 смользар/кг и при рН 6 – 59 СМОЛЬзар/кг. Ответ: при рН 3; 4; 5 и 6 доля продиссоциировавших карбоксильных групп составит 0,09; 0,50; 0,91 и 0,99 соответственно; заряд, связанный с гумусом, составит 5,5; 30; 54 и 59 смользар/кг соответственно. Пример 13. Доза меди, рекомендуемая для внесения в конкретную почву, составляет 115 мг/кг почвы. (Медь входит в состав хлорофилла и играет важнейшую роль в процессах метаболизма и фотосинтеза. Дефицит меди приводит к снижению урожая). Если почва содержит 2,5% гумуса с отрицательным зарядом 65 смользар/кг гумуса и вся медь прочно связывается гумусом при образовании хелатных комплексов, какой процент заряда гумуса нейтрализуется? Решение. В соответствии с условием задачи, в почве протекает следующая реакция: 2А– + Cu2+® A2Cu. Таким образом, решение задачи сводится к определению избытка одного из реагентов. Количество молей вносимой меди равно (nCu):
где m – масса меди, вносимая в почву; МCu – 63,5 – молярная масса атомов меди;
Поскольку заряд катиона меди равен +2, то суммарный заряд, вносимый с медью (дзар), будет равен удвоенному числу молей атомов меди и составит 1,8 • 10–3 • 2 = 3,6 • 10–3 мользар/кг. Заряд, связанный с гумусом (qпочв), составит: qпочв = mгумqгум где mryм – масса гумуса; qгум – заряд, связанный с гумусом в 1кг почвы; qпочв = 0,025 • 1 • 65 • 10–2 = 16,25 • 10–3 (мользар/кг). Процент компенсированного заряда (г) составит:
Ответ: нейтрализуется 22% заряда гумуса. Пример 14. ЕКО почвы составляет 25 смользар/кг; 65% ЕКО обусловлены ионами Н+ и А13+. Рассчитайте количество извести (г СаСО3/кг почвы), необходимое для нейтрализации этой обменной кислотности. Решение. Согласно условию задачи, количество зарядов (q), обусловленное ионами Н+ и А13+, составляет: q = ЕКО • р, где р – доля заряда, обусловленная ионами Н+ и А13+; q = 25 • 10–2 • 0,65 = 16,25 • 10–2 (мользар/кг). Необходимое количество СаСО3 для нейтрализации с учетом того факта, что ионы кальция несут заряд +2, определяется из следующего равенства: где МCаСОз – молярная масса карбоната кальция, равная 100 г/моль.
Ответ: для нейтрализации необходимо 8,1 г СаСО3/кг почвы. Пример 15. После встряхивания 10 мл почвы с 50 мл 1 М раствора NH4NO3 в течение 30 мин суспензию отфильтровали и установили, что содержание катионов К+ в растворе составляет 18 мкг/мл. Определите содержание «подвижного» калия в почве. Сколько калийных удобрений потребуется внести для увеличения содержания экстрагируемого К+ в этой почве до 180 мг/л почвы? Предположите, что весь внесенный К+ остается в экстрагируемой форме, что плотность сухой почвы в измерительной чашке равен 1 г/см3 и что масса почвы составляет 2500 т/га. Решение. Для решения этой задачи следует использовать методы расчета, применяемые в аналитической химии, в частности закон сохранения эквивалентов. Тогда концентрация подвижного калия в почве (CK+) определяется следующим соотношением:
где С1 – концентрация К+ в анализируемом растворе, г/мл; VH – объем навески почвы, мл; V1– аликвота водного раствора, мл; Vq – требуемый объем (1000 мл);
Определим количество калия, необходимое для увеличения его содержания с 0,09 до 0,18 г/л почвы: Dm = 0,18 – 0,09 = 0,09 (гК+/л почвы). Пересчитаем эту величину на кг почвы, используя соотношение: Dmm = где ρ – плотность почвы, кг почвы/л почвы. Общее количество ионов калия (Мк+) определим из следующего выражения: Мк+ = DmmW, где W – масса 1га почвы; Мк+ = 0,09 • 2500 • 103 = 220 • 103 (г К+/га) = 220(кгК+/га). Ответ: содержание подвижного калия в почве – 0,09 г/л почвы; для увеличения содержания в почве ионов калия до требуемого уровня необходимо внести 220 кг К+/га. Пример 16. В 100г дерново-подзолистой почвы в поглощенном состоянии содержится 240 мг подвижного кальция, 26 мг магния, 3,6 мг аммония, 1 мг подвижного водорода и 2,7 мг алюминия. Рассчитайте ЕКО. Решение. Решение задачи сводится к нахождению суммарного заряда (ЕКО), определяемого перечисленными ионами, выраженного в молях:
где mи – количество ионов в навеске; Ми– молярная масса ионов; mн – масса навески; k – коэффициент, учитывающий величину заряда соответствующего иона.
Ответ: ЕКО = 15 смользар/кг почвы. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ППК(М
ППК(М 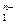 ) + nM
) + nM  ППК(М
ППК(М  )n+mM
)n+mM  ,(7)
,(7) (8)
(8)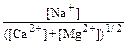 (9)
(9) RCOOH RCOO– + H+.
RCOOH RCOO– + H+.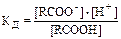
 ,
,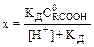
 – исходная концентрация карбоксильных групп.
– исходная концентрация карбоксильных групп. = 5,5 . 10–2(моль/кг)
= 5,5 . 10–2(моль/кг)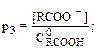
 .
. ,
,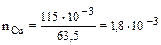 (моль/кг почвы).
(моль/кг почвы).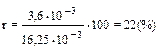
 q = nСаСОз =
q = nСаСОз =  ,
,
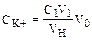
 (г/л почвы)
(г/л почвы) = 0,09 (гК+/кг почвы),
= 0,09 (гК+/кг почвы), ЕКО =
ЕКО =  å
å 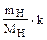

 (мользар/кг почвы) = 15(смользар/кг почвы)
(мользар/кг почвы) = 15(смользар/кг почвы)