
|
|
Закона внешнего фото эффектаЗаконы фотоэффекта: Формулировка 1-го закона фотоэффекта: количество электронов, вырываемых светом с поверхности металла за единицу времени на данной частоте, прямо пропорционально световому потоку, освещающему металл. Согласно 2-ому закону фотоэффекта, максимальная кинетическая энергия вырываемых светом электронов линейно возрастает с частотой света и не зависит от его интенсивности. 3-ий закон фотоэффекта: для каждого вещества существует красная граница фотоэффекта, то есть минимальная частота света ν0 (или максимальная длина волны λ0), при которой ещё возможен фотоэффект, и если ν < ν0, то фотоэффект уже не происходит.
Уравнение Эйнштеина для внешнего фотоэффекта А. Эйнштейн в 1405 г. показал, что явление фотоэффекта и его закономерности могут быть объяснены на основе предложенной им квантовой теории фотоэффекта. Согласно Эйнштейну, свет частотой v не только испускается, как это предполагал Планк, но и распространяется в пространстве, и поглощается веществом отдельными порциями (квантами), энергия которых e0 = hn.
Связь между максимальной кинетической энергии фотоэлектрона и задерживающим напряжением Вольт-амперная характеристика фотоэлемента Масса покоя фотона Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») — элементарная частица, квант электромагнитного излучения (в узком смысле — света). Это безмассовая частица. Массу покоя фотона считают равной нулю, Поэтому скорость фотона равна скорости света. По этой причине (не существует системы отсчёта, в которой фотон покоится) внутренняя чётность частицы не определена. Энергия фотона Энергия фотона:
где ν — частота, λ — длина волны света, h = б,626·10-34 Дж·с = 4,136·10-15 эВ ·с, Обобщенная формула Бальмера Таким образом, волновые числа всех спектральных линий известных серий атомарного водорода можно вычислить по формуле, которая называ-ется обобщенной формулой Бальмера:
где k = 1 для серии Лаймана, k = 2 для серии Бальмера, k = 3 для серии Пашена, k = 4 для серии Брэкета, k = 5 для серии Пфунда, n = k+1, k+2,… Постулаты Бора Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов (формула Бальмера-Ридберга) и квантового характера испускания и поглощения света. Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн. Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам для которых момент импульса квантуется: , где n — натуральные числа, а — постоянная Планка. Пребывание электрона на орбите определяет энергию этих стационарных состояний. При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии hν = En − Em, где En;Em — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда. Выражение для волны де-Бойля формула для длины волны де Бойля
Физический смысл волновой функции Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении.
Принцип Паули При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона не могут одновременно находиться в одном квантовом состоянии. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения Np = 0,1 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


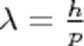
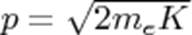 (для электрона)
(для электрона)