
|
|
Определение теплоемкости продуктов сгоранияКоличество тепла, заключенное в каком-либо теле, увеличивается (или уменьшается) при изменении его температуры. Коэффициент пропорциональности между количеством подведенной к телу теплоты и изменением его температуры называется теплоемкостью Как правило, теплоемкость всех тел (твердых, жидких и газообразных) зависит от температуры. Для газов, в отличие от твердых и жидких тел, теплоемкость в сильной степени зависит и от других внешних параметров (давление, объем), при которых происходит отнятие или сообщение тепла. Поэтому для газов различают теплоемкость при постоянном давлении
где R – универсальная газовая постоянная, кал/моль·град.; k – показатель адиабаты рассматриваемого газа. Величина показателя адиабаты k зависит от структуры молекул газа: для одноатомных газов (аргон, гелий и др. ) В инженерной практике чаще используется изобарная теплоемкость. Зависимость ее от температуры для различных газов в справочной литературе обычно задается уравнениями:
по которым может быть определена истинная теплоемкость тела при любой температуре и построен график зависимости В инженерной практике обычно пользуются не истинными, а средними теплоемкостями. Средняя теплоемкость для заданного интервала температур представляет собой число, равное значению
Определение жаропроизводительности топлива
Весьма важной характеристикой топлив является максимальная температура, развиваемая в топке при их сжигании, которую Д.И.Менделеев предложил назвать жаропроизводительностью. При подсчете жаропроизводительности принимают, что все тепло, выделяемое при полном сгорании топлива, используется для нагрева продуктов сгорания. Потери тепла в окружающую среду принимают равными нулю. Диссоциацию продуктов сгорания при высоких температурах, которая сопровождается поглощением тепла, обычно не учитывают. Если предположить, что все тепло, выделяющееся в результате сгорания топлива, целиком сообщается только продуктам, а температура топлива и воздуха, подаваемых в топку, равна нулю, тогда
где
4. ЗАДАНИЯ ДЛЯ ПРАКТИЧЕСКИХ РАБОТ Задание №1 а) По заданной функции изобарной теплоёмкости газа б) Рассчитать значения средней теплоемкости газа для значений температур: ΔТ = 298-400º; ΔТ = 298-500º; и т.д. и нанести найденные значения Номер варианта для выполнения Задания 1 принимать по данным табл. П 1.2 (разделы 2-4) в соответствии с порядковым номером студента в списке группы.
Рис.1. Зависимость теплоемкости газа от температуры Задание №2 а) По данным элементарного состава твердого сухого беззольного топлива определить теплоту сгорания (высшую и низшую) разными способами: расчетом по реакциям горения с использованием стандартных теплот образования веществ и по эмпирической формуле Д.И.Менделеева. Результаты сравнить. Пересчитать состав топлива и найденные значения б) По данным элементарного состава твердого топлива (рабочее состояние) рассчитать показатели его сжигания: теоретический расход кислорода и воздуха, количество и состав продуктов сгорания и жаропроизводительность при
Задание №3 а) По данным компонентного состава сухого газообразного топлива определить значения высшей и низшей теплот сгорания по реакциям окисления компонентов и стандартным теплотам образования веществ.
б) Рассчитать количества воздуха, теоретически необходимого для сжигания газа и фактически подаваемого в топку при заданном коэффициенте избытка воздуха. Рассчитать количество (объем) и состав продуктов сгорания и жаропроизводительность при
Исходные данные для выполнения работ №2 и №3 приведены в табл. П.2.1 и П.2.2 (Варианты выбираются по двум последним цифрам номера зачетной книжки студента).
ЛИТЕРАТУРА
1. Брицке, Э.В., Капустинский, А.Ф., Веселовский, Б.К. и др. Термодинамические константы неорганических веществ [Текст]. – М.: Изд-во АН СССР, 1949. – 243 с. 2. Бэр, Г.Д. Техническая термодинамика [Текст]. – М.: Мир, 1977. – 518 с. 3. Захаров, Н.Д. Эксергия органических топлив [Текст] // Известия вузов. Энергетика. – 1970. – № 9. – С. 63– 67. 4. Карапетьянц, М.Х., Карапетьянц, М.Л. Основные термодинамические константы неорганических и органических веществ [Текст]. – М.: Химия, 1968.– 470 с. 5. Краткий справочник физико-химических величин [Текст] /под ред. К.П.Мищенко и А.А.Равделя. – Л.: Химия, 1972. – 200 с. 6. Линчевский, В.П. Топливо и его сжигание [Текст]. – М.: Металлургиздат, 1959. – 400 с. 7. Равич, М.Б. Топливо и эффективность его использования [Текст]. – М.: Наука, 1971. 8. Справочник химика [Текст] – М.: Госхимиздат, 1968. – 272 с. 12. Степанов, В.С., Степанова, Т.Б. Эффективность использования энергии [Текст]. – Новосибирск: Наука, Сиб. отд-ние, 1994. – 257 с. 13. Шаргут, Я., Петела, Р. Эксергия [Текст]. – М.: Энергия, 1968. – 272 с. 14. Энергетическое топливо СССР [Текст]: справочник/В.С.Вдовченко, М.И.Мартынова, Н.В.Новицкий, Г.Д.Юшина. – М.: Энергоатомиздат, 1991.–184 с.
ПРИЛОЖЕНИЕ 1 Таблица П 1.1 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 . Удобнее пользоваться понятием теплоемкости, отнесенной к единице массы
. Удобнее пользоваться понятием теплоемкости, отнесенной к единице массы  Удельной теплоемкостью какого-либо тела называется количество тепла, которое необходимо сообщить единице массы (или объема), чтобы повысить его температуру на 1 градус.
Удельной теплоемкостью какого-либо тела называется количество тепла, которое необходимо сообщить единице массы (или объема), чтобы повысить его температуру на 1 градус.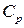 и теплоемкость при постоянном объеме
и теплоемкость при постоянном объеме  . Теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме. Соотношения между ними характеризуются следующими равенствами:
. Теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме. Соотношения между ними характеризуются следующими равенствами: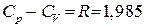 ;
;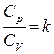 ,
, 1,67, для двухатомных (кислород, азот, окись углерода)
1,67, для двухатомных (кислород, азот, окись углерода)  1,33.
1,33. или
или  ,
, для рассматриваемого вещества. Площадь под кривой
для рассматриваемого вещества. Площадь под кривой  .
. .
. ,
, – масса i-го продукта;
– масса i-го продукта;  – средняя удельная его теплоемкость для соответствующего интервала температуры.
– средняя удельная его теплоемкость для соответствующего интервала температуры. рассчитать значения
рассчитать значения  как показано на рис. 1.
как показано на рис. 1. на построенный график
на построенный график 
 и
и  на сухую и рабочую массы топлива. Произвести пересчет состава и теплот сгорания топлива на другое содержание влаги.
на сухую и рабочую массы топлива. Произвести пересчет состава и теплот сгорания топлива на другое содержание влаги. =1 и при заданном
=1 и при заданном