
|
|
Определение теплоты сгоранияТеплоту сгорания можно определять двумя путями. Первый из них заключается в непосредственном измерении количества тепла, выделяющегося при сжигании определенного количества исследуемого горючего, т.е. путь экспериментальный. Второй путь основан на том, что эта характеристика вычисляется исходя из теплоты горения горючих составляющих топлива и, следовательно, определяется содержанием последних в горючем. Таким образом, во втором случае требуется знание точного состава топлива и тех тепловых эффектов, какими сопровождаются реакции окисления горючих составляющих. Определение теплоты сгорания топлива по данным элементарного анализа. Поскольку по закону Гесса теплота сгорания соединения равна разности между теплотами сгорания углерода, водорода и серы и теплотой образования молекулы, то для вычисления теплотворности топлива необходимо знать не только содержание в нем углерода, водорода и серы, но и природу тех соединений, в которых эти элементы присутствуют в топливе. Основой метода определения расчетной теплоты сгорания всякого топлива является представление об этой величине как о сумме теплот сгорания содержащихся в топливе элементов или их соединений. Таким образом, для такого рода подсчета должны быть известны количества различных составляющих в топливе (его химический состав) и теплоты сгорания их. Для топлива тех видов, анализом которых невозможно установить количество и вид соединений элементов горючей массы, построение рациональной формулы для определения теплотворности, естественно, наталкивается на непреодолимые затруднения, в результате чего можно говорить лишь о большей или меньшей степени приближения. В 1843 г., спустя пять лет после смерти известного французского химика П.Дюлонга (правильнее Дюлона), были опубликованы его материалы по подсчету теплоты сгорания. Они легли в основу многочисленных вариантов его формулы, построенной исходя из следующих предположений: 1) кислород, содержащийся в горючей массе топлива, полностью связан с водородом; 2) при сгорании водорода в воду (без испарения), не связанного с кислородом, или так называемого свободного водорода, выделяется такое же количество тепла, как и при сгорании газообразного молекулярного водорода; 3) топливо рассматривается как механическая смесь углерода, свободного водорода и горючей серы, тепло распада молекул не учитывается. Формула Дюлонга предназначена для подсчета высшей теплоты сгорания. Для подсчета низшей теплоты сгорания Бунте в 1891 г. предложил формулу, отличающуюся от формулы Дюлонга тем, что в ней учитывается расход тепла на испарение воды, образующейся при сгорании свободного водорода и содержащейся в топливе влаги (около 2,51 МДж на 1 кг влаги). К формуле Бунте близка формула Общества германских инженеров (1899 г.). В несколько измененном виде формулы Бунте и Общества германских инженеров до настоящего времени широко используются в странах Западной Европы. Ф.Шустер придает формулам Дюлонга и Общества германских инженеров следующий вид
Указанные формулы пригодны для подсчета лишь теплоты сгорания каменных углей и приводят к серьезной погрешности при определении теплоты сгорания других видов топлива. Д.И.Менделеев, изучая свойства топлива, убедился в неточности предлагаемых формул и ошибочности многих принятых положений. Во-первых, теплота сгорания водорода, содержащегося в сложных органических соединениях, образующих твердое топливо, принята равной теплоте сгорания молекулярного газообразного водорода – около 142,4 МДж/кг. Во-вторых, совершенно необоснованно весь кислород, содержащийся в горючей массе топлива, признается находящимся в химической связи с водородом. Главным возражением против общей применимости указанной формулы служит то, «что она представляет топливо как механическую смесь горючих углеводорода и водорода и негорючей воды, не принимая вовсе во внимание того, что при акте образования всякого химического соединения выделяется или поглощается тепло, а потому при горении химических соединений не может выделяться столько же тепла, как и при горении составных начал, из которых они могут образоваться. Притом гипотеза о содержании в топливе всего кислорода в виде воды ни на чем не основана». Д.И.Менделеев задался целью разработать универсальную формулу, пригодную для подсчета теплоты сгорания всех видов твердого и жидкого топлива. Теплоту сгорания водорода, входящего в состав органических соединений твердого и жидкого топлива, Д.И.Менделеев признал меньшей, чем газообразного молекулярного водорода, и равной не 142,4 МДж/кг, а 125,6 МДж/кг. Кроме того, он полагал, что кислород находится в химическом соединении не только с водородом, но и углеродом. В соответствии с этим он считал необходимым отказаться от понятия свободного, или «горючего», водорода и вести подсчет теплоты сгорания топлива, исходя из содержания всего количества водорода в его горючей массе. Снижение теплоты сгорания вследствие содержания в горючей массе кислорода Д.И.Менделеев подсчитал на основании теплоты сгорания ряда видов топлива с различным содержанием кислорода, оно оказалось равным 10,9 МДж на 1 кг кислорода, т.е. 108,5 кДж на каждый процент его содержания в горючей массе. Для подсчета высшей теплоты сгорания топлива Д.И.Менделеев предложил весьма простую формулу:
Применимость этой формулы была проверена Д.И.Менделеевым путем подсчета по составу теплоты сгорания различных видов горючего, а именно: углерода, клетчатки, каменных углей и нефтепродуктов, теплота сгорания которых была определена калориметрическим методом, В результате он пришел к выводу, что предложенная формула дает достаточно точное совпадение с результатами калориметрических определений различных видов топлива. Свою формулу Д.И.Менделеев доложил 6 февраля 1897 г. на заседании Отделения химии Русского физико-химического общества. В том же году она была опубликована. На первый взгляд может показаться, что в формуле Менделеева не учтено содержание в топливе балласта, т.е. влаги, минеральных веществ и азота. В действительности это не так. Содержание балласта в топливе сказывается на понижении подсчитываемой по формуле Д.И.Менделеева теплоты сгорания топлива в результате соответствующего снижения содержания горючих компонентов. При подсчете низшей теплоты сгорания топлива, т.е. с учетом тепла, расходуемого на испарение воды, образующейся при сгорании водорода и содержащейся в топливе, формула Д.И.Менделеева приобретает следующий вид
или
Подсчет теплоты сгорания газообразного топлива по компонентному составу.Высшую и низшую теплоту сгорания газообразного топлива посчитывают на основе реакций окисления компонентов и стандартных теплот образования веществ по формулам:
+ 1,285 C4H10 + 1,578 C5H12 + 0,628 C2H4 + 0,921 C3H6 + 1,214 C4H8 + + 1,507 C5H10 + 1,465 C6H6 + 0,255 H2S МДж/м3. (2.6)
+ 1,206 C4H10 + 1,461 C5H12 + 0,590 C2H4 + 0,858 C3H6 + 1,135 C4H8 + + 1,411 C5H10 + 1,403 C6H6 + 0,234 H2S МДж/м3. (2.7) Для природных и попутных нефтепромысловых газов с высоким содержанием CH4, включающих помимо метана его гомологи, а также углекислый газ, сероводород и азот, низшую теплоту сгорания можно подсчитать по формуле с округленными коэффициентами:
+ 1,465 C5H12 + 0,251 H2S МДж/м3. (2.8)
3. РАСЧЕТЫ ГОРЕНИЯ ТОПЛИВА
Целью расчетов является определение показателей, характеризующих условия сжигания топлива заданного состава, количества и состава образующихся продуктов сгорания, температуры горения (жаропроизводительность) топлива и др. Все расчеты по определению перечисленных величин могут быть выполнены по данным элементарного анализа участвующих в процессе горения веществ на основании стехиометрических соотношений соответствующих химических уравнений. Например, уравнение С + О2 = СО2 + ∆Hr помимо качественного описания процесса горения дает строгую количественную его характеристику. На основании законов о постоянстве массовых отношений, закона Гесса о независимости теплового эффекта реакции от пути ее реализации и промежуточных процессов, законов сохранения материи и энергии можно утверждать, что образование 1 моля (44 г) двуокиси углерода требует израсходования 1 моля (12 г) углерода и 1 моля (16 г) кислорода. При этом процесс сопровождается выделением тепла в количестве 97650 кал. Подобные уравнения, описывающие процесс окисления отдельных элементов (компонентов) топлива, и являются основой метода расчета названных выше характеристик.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
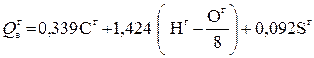 МДж/кг; (2.1)
МДж/кг; (2.1) МДж/кг. (2.2)
МДж/кг. (2.2) МДж/кг. (2.3)
МДж/кг. (2.3) МДж/кг, (2.4)
МДж/кг, (2.4) МДж/кг. (2.5)
МДж/кг. (2.5) = 0,126 CO + 0,128 H2 + 0,398 CH4 + 0,695 C2H6 + 0,992 C3H8 +
= 0,126 CO + 0,128 H2 + 0,398 CH4 + 0,695 C2H6 + 0,992 C3H8 +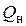 = 0,126 CO + 0,108 H2 + 0,358 CH4 + 0,636 C2H6 + 0,913 C3H8 +
= 0,126 CO + 0,108 H2 + 0,358 CH4 + 0,636 C2H6 + 0,913 C3H8 +