|
|
А - периодического действия; б - проточный с перемешиванием; в - с неподвижным слоем (проточный); г - с рециклом; д - горизонтальный с неподвижным слоем; е - проточный с взвешенным (“кипящим”) слоем
Относительная скорость движения жидкости и гранул в реакторах со взвешенным слоем невелика, что невыгодно с точки зрения обеспечения биокатализатора субстратом. Более удобными представляются реакторы с движущимся фиксированным слоем биокатализатора, когда расположение его гранул фиксировано друг относительно друга (это исключает также механическое повреждение гранул). Предложен ряд вариантов реакторов с вращающимся перфорированным контейнером (рис.6а), с кассетами диффузорами и мешалкой (рис.6б), а также реакторы типа "активный ротор" с перфорированными кассетами, выполняющими роль мешалки (рис.6в).
в Рис.6 Реакторы с движущимся фиксированным слоем биокатализатора А – с вращающимся перфорированным ротором; б – с кассетами – диффу-зорами; в – типа активный ротор
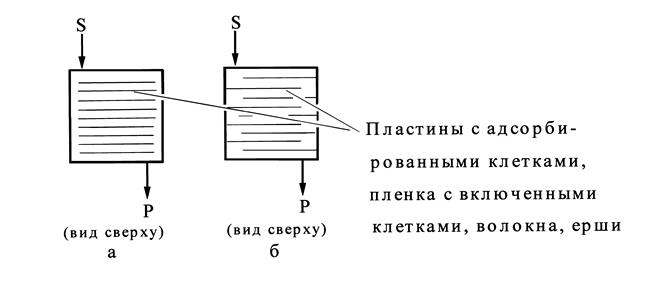
В больших реакторах возникает эффект неоднородности слоя биокатализатора, вследствие чего поток жидкости проходит преимущественно по зонам с низким гидравлическим сопротивлением. Одним из возможных решений проблемы представляется использование проточных реакторов с упорядоченным расположением биокатализатора. Примером служит реактор с носителем в виде пакета пластин (пластинчатый реактор рис.7а,б), покрытых слоем микроорганизмов. Можно использовать и реактор, в корпусе которого заключена кассета (в том числе съемная), на которой размещена пленка-адсорбент или волокна, ерши и другие элементы, обладающие развитой поверхностью и служащие адсорбентом микроорганизмов (рис.7в). К данной категории относится также горизонтальный реактор с параллельно расположенными вращающимися дисками, выполненными в виде кассеты, закрепленной на оси (рис.7г). Реактор с вращающимися дисками применяют для получения этанола, другие виды реакторов с упорядоченным расположением биокатализатора используют при очистке сточных вод, в процессах бактериального выщелачивания руд.
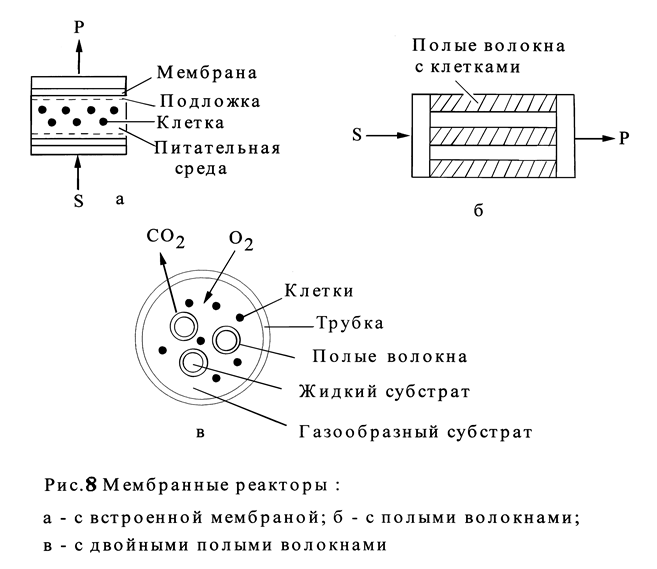
МЕМБРАННЫЕ РЕАКТОРЫ Мембранный реактор представляет собой аппарат, в котором одновременно осуществляется проведение двух процессов - управляемого культивирования свободных микроорганизмов в объеме реактора и удаление продуктов (и замены их субстратом) с помощью мембранного модуля. В зависимости от расположения мембранного модуля мембранные реакторы разделяют на те, у которых мембрана является элементом конструкции самого реактора, а также на реакторы с выносными фильтрационными модулями (по форме реакторы могут быть плоскими, половолокнистыми и др.). Эксплуатация реакторов первого типа происходит в более строго контролируемых условиях, однако замена мембраны осложнена (замена мембраны необходима, так как она неизбежно засоряется клеточными обломками и коллоидными частицами). Этот недостаток исключается в реакторах второго типа, однако им присуща опасность заражения, а также циклически неконтролируемых изменений давления и концентрации компонентов в выносном фильтрационном модуле. Материал фильтрационных мембран может быть различным - керамические и металлокерамические фильтры, стерилизуемые полимерные матрицы, ионообменные мембраны. По типу мембраны разделяются на фильтрационные и диализные: в первом случае массоперенос через мембрану осуществляется за счет разницы давления над и под мембраной; во втором - за счет градиента концентраций над и под мембраной. Принципиальная схема мембранного реактора, у которого мембрана является элементом его конструкции, приведена на рис.8а Реактор с выносным модулем представляет собой реактор с перемешиванием (с гомогенной средой) и циркуляцией среды через модуль. Третий тип мембранного реактора относится к тому случаю, когда клетки каким-либо образом прикреплены к мембране или находятся внутри самой мембраны. Чаще всего для этого используют мембраны, представляющие полые волокна, на поверхности которых закреплены клетки и через которые поступает субстрат и одновременно отводятся продукты (рис.8б). Модификацией такого реактора является реактор с двойными полыми волокнами (рис.8в), когда в пористое полое волокно большого диаметра (трубку) заключены полые пористые волокна меньшего диаметра и в межволоконном пространстве находятся клетки. Этот реактор целесообразно использовать, когда субстраты и (или) продукты находятся в жидкой и газообразной фазе. Газообразные компоненты реакционной системы подаются (удаляется) через стенку волокна большего диаметра, а жидкая компонента - через волокно меньшего диаметра. Установлено, что мембранные реакторы можно использовать для культивирования практически всех эукариотических и прокариотических микроорганизмов, как в аэробных, так и в анаэробных режимах. Их применяют, в частности, для получения ферментов, антибиотиков, витаминов, аминокислот, органических кислот, этанола, бутанола, ацетона, акриламида. Мембранные реакторы относятся к ферментационному оборудованию нового поколения. В настоящее время ведутся исследования по использованию функциональных мембран с активными переносчиками, иммобилизованными ферментами, аффинными сорбентами и т.д. В настоящий момент применение мембранных реакторов тормозится определенным дефицитом мембранных материалов и необходимостью ломки традиций и стереотипов.
ПОЛИМЕРНЫЕ БИОМАТЕРИАЛЫ Под полимерными биоматериалами обычно понимают полимерные материалы и изделия из них, которые используются в медицине или биотехнологии. Такие материалы часто получают путем целенаправленного модифицирования хорошо известных полимеров. За последние годы значительно возросли ассортимент, масштабы производства и значение биоматериалов. Радиационно-химическая технология в настоящее время стала одним из наиболее эффективных способов получения полимерных биоматериалов. Работы по использованию радиационно-химических методов для синтеза полимерных биоматериалов проводятся в следующих направлениях: радиационное модифицирование различных полимеров и изделий из них с целью получения гемосовместимых (длительно работающих в контакте с кровью) полимеров, полимерных сорбентов, протезов сосудов и т.д.; иммобилизация различных биологически активных веществ (БАВ) (ферменты, лекарства и т.д.) в полимерные матрицы с использованием радиационной полимеризации; радиационно-химический синтез полимеров-носителей лекарственных препаратов; радиационное сшивание полимеров с целью получения механически прочных гидрогелей (носители БАВ, перевязочные материалы глазные линзы и т.д.). Преимуществом радиационно-химических методов получения полимерных биоматериалов по сравнению с традиционными является чистота материалов (нет необходимости добавлять дополнительные ингредиенты (инициаторы полимеризации) при синтезе), возможность проведения процессов при пониженных температурах и легкость регулирования скорости процессов путем изменения мощности дозы излучения. Достоинством радиационно-химических методов является также то, что биоматериалы в некоторых случаях можно стерилизовать на тех же источниках ионизирующих излучений, которые уже были использованы для их получения. Необходимо отметить, что в большинстве случаев для получения полимерных биоматериалов требуются небольшие дозы излучения, как правило, не превышающие 30 кГр, что позволяет использовать источники излучений невысокой мощности. Недостатком радиационно-химических методов является необходимость применения, как правило, сравнительно дорогостоящих и сложных в эксплуатации источников γ-излучения и электронных ускорителей.
1. Получение гемосовместимых полимерных материалов.Получение гемосовместимых полимерных материалов - весьма сложная проблема. При контакте полимеров кровью инициируются биохимические реакции, вызывающие изменение физиологических функций крови, «запускается» свертывающая система крови с последующим тромбообразованием на поверхности полимера. Важными факторами, повышающими гемосовместимость полимеров, являются такие их свойства, как минимальная способность к адгезии и агрегации тромбоцитов, отсутствие активации контактных факторов свертывания крови, участие в реакции лизиса образующегося тромба и селективная способность к адсорбции белков плазмы крови, в особенности альбумина. Согласно современным представлениям, первой стадией при контакте полимера с кровью является быстрая сорбция белков из плазмы крови. Природа и конформационное состояние белка определяют последующие биохимические реакции. Проблемы сорбции белков на различных полимерных поверхностях рассматривались в многочисленных исследованиях. К сожалению, в настоящее время уровень наших знаний не позволяет достаточно эффективно прогнозировать природу и свойства полимерной поверхности, полностью удовлетворяющей требованию гемосовместимости. Из изложенного ясно, что для получения гемосовместимых материалов поверхность полимеров необходимо модифицировать. С этой целью: 1. Создают полимеры с поверхностями, обладающими пониженной адсорбционной способностью по отношению к белкам и близкими по своей природе к естественной среде организма. В основном это гидрогелевые поверхности 2. Создают полимерные материалы с определенной доменной структурой поверхности (полиуретаны). 3. Создают углеродные полимерные материалы (полиацетилены). 4. Создают полимеры, поверхность в которых по своей природе моделирует антикоагулянты крови), что достигается введением в поверхностные слои полимеров сульфо- и карбоксильных групп, созданием отрицательного заряда на поверхности полимеров). Чаще всего стараются получить гепариноподобную поверхность, так как широко распространенный метод получения гемосовместимых материалов путем введения гепарина имеет ряд недостатков, обусловленных частичной утратой активности гепарина при ковалентной иммобилизации, его слабой антикомплементной активностью и биодеструкцией. 5. Вводят в поверхностные гидрогелевые слои физиологически активные вещества (антикоагулянты крови, ферменты и т.д.), взаимо-действующие с компонентами крови и приостанавливающие процесс тромбообразования. При выборе метода модифицирования поверхности полимеров необходимо учитывать, что основные физико-механические показатели исходного полимера при модифицировании не должны существенно измениться. Одним из наиболее эффективных методов модифицирования полимеров является радиационная прививочная полимеризация. Достоинствами ее как метода модифицирования полимерных материалов с целью повышения их гемосовместимости являются, во-первых, высокая универсальность, позволяющая в широком диапазоне температур модифицировать практически любые полимерные материалы (шовный материал, катетеры, трубки, таблетки, порошки, трансплантаты и т.д.); во-вторых, возможность создания на поверхности полимеров модифицированных слоев различной толщины. Толщина слоя зависит от условий проведения прививочной полимеризации — мощности дозы, выбора растворителя для мономера и т.д. При этом модифицированный слой прочно связан с подложкой и не отмывается при контакте со средой живого организма. Все это способствует достаточно широкому использованию радиационной прививочной полимеризации для решения проблем, связанных с повышением гемосовместимости различных полимерных материалов и изделий из них. Основной задачей таких исследований является создание полимеров с функционализированной поверхностью, определенными гидрофильно-гидрофобными свойствами и отрицательным зарядом на поверхности. Значительное количество работ выполнено по модифицированию различных полимеров с использованием высокогидрофильных мономеров, таких как N-винилпирролидон, 2-гидроксиэтил-метакрилат, акриламид и его производные. В ряде исследований для модификации брали достаточно сложные сополимеры. Так, для производства протезов сосудов использовали, в основном, полиуретаны, полиэфиры и натуральный каучук. Радиационную прививочную полимеризацию в большинстве случаев осуществляли прямым методом из водно-спиртовых растворов при небольших дозах облучения. В некоторых случаях, особенно при прививке акриламида, применяли метод с предоблучением. В результате проведенных работ получены разнообразные модифицированные полимерные материалы с гидрогелевыми поверхностями. Эти материалы достаточно прочны, мягки и обладают высокой набухаемостью в воде. Биомакромолекулы в таких материалах характеризуются повышенной диффузией. Полимерные гидрогели, полученные радиационно-химическими методами, испытаны на гемосовместимость в экспериментах in vitro и in vivoна обезьянах, овцах и собаках. В обобщенном виде испытания на гемосовместимость радиационно-привитых полимерных гидрогелей показали следующее: с повышением содержания воды от 15 до 85% происходит уменьшение сорбции белков и повышается скорость десорбции, на гидрогелях имеет место тромбообразование, но связь тромбов с гидрогелевой поверхностью заметно ослаблена по сравнению с их связью с немодифицированными полимерами. Существенно важным является значительное понижение поверхностного натяжения между гидрогелем и водным раствором. Гидрогелевое покрытие на полимерах должно быть приготовлено из очень чистых мономеров. Так, незначительная примесь метакриловой кислоты б 2-гидроксиэтилметакрилате значительно ухудшает качество гидрогелевого покрытия и его гемосовместимые свойства. Интересные результаты были получены при изучении радиационно привитых на полиэтилен (ПЭ) сополимеров 2-гидроксиэтилметакрилата (гидрофильный мономер) с этилметакрилатом (гидрофобный мономер). При низком содержании воды (~10%) указанные привитые сополимеры характеризовались неожиданно низкими показателями адсорбции тромбоцитов, что было обусловлено не содержанием воды, а составом сополимера. При более высоком содержании воды адсорбция тромбоцитов обратно пропорциональна содержанию воды. Очевидно, что состав сополимера и состояние воды в нем имеют важное значение. Поверхность радиационно-привитых сополимеров очень неоднородна (имеются бугры, выступы и т.д.), толщина модифицированного слоя, как правило, 15-45 мкм. Предполагается, что для повышения гемосовместимости необходимо определенное сочетание на поверхности гидрофильных и гидрофобных участков. 2. Использование радиационного сшивания для получения полимер-ных биоматериалов.В настоящее время существенно возрос интерес к получению полимерных биоматериалов путем радиационного сшивания. Этот метод наиболее часто применяется для получения гидрогелей, главным образом на основе полиакриламида, поливинилового спирта, полиэтиленоксида и поли(N-винилпирролидона). Преимуществом радиационного сшивания является сравнительная простота выполнения, возможность широкого регулирования густоты сетки путем подбора условий облучения (мощность дозы, доза), возможность использования пониженных температур, чистота получаемого продукта (отсутствие инициаторов) и одновременная стерилизация. Радиационно-сшитые гидрогели используются как носители БАВ (ферменты, лекарства и т.д.) в качестве имплантантов, протезов, глазных линз, медицинских мембран, перевязочных материалов и биологических сред для изучения и культивирования микроорганизмов. На основе радиационно-сшитого поливинилового спирта получены биомембраны для селективного транспорта макромолекул, а также материалы, использующиеся в качестве суставных хрящей. Показана перспективность использование гидрогелей поливинилового спирта в качестве перевязочного материала и отмечено его преимущество перед марлей: гомогенная адгезия по всей ране и легкое удаление без повреждения кожи. Гидрогели на основе поли(N-винилпирролидона) обладают высокой гидрофильностью и хорошей биосовместимостью и могут использоваться в качестве материала для лечения ожоговых ран и трофических язв. Данные материалы продаются в Польше под торговыми марками “HDR” и “AQUA-Gel”. Разработана терапевтическая система на основе геля поли(N-винилпирролидона) для использования в акушерской практике для ускорения родов и производства абортов. В этом случае гель представляет собой тонкий стержень, содержащий простагландин. Технология получения гидрогелей для перевязочных материалов в настоящее время достаточно подробно разработана, и они прошли широкие клинические испытания. Важно, что есть возможность получать гели для перевязок, содержащие лекарственные препараты (например, хлорамфени-кол). При больших ранениях такой гидрогель существенно эффективней обычных перевязочных материалов. В медицине применяются покрытия силиконового каучука коллагеном с последующим радиационным сшиванием и стерилизацией. Другим природным продуктом, который используется для получения биоматериалов, является желатин. Изучен радиолиз желатины, выявлены условия образования пространственных структур при облучении ее растворов. Предложено использовать радиационно-сшитую композицию поливинилового спирта с желатином в качестве перевязочного материала. Радиационное сшивание использовано для изготовления медицинских изделий из полисилоксанов: биологически инертных пористых шнуров, шприцованных трубок, капилляров и разных имплантантов. При радиационном сшивании полидиметилсилоксана в особочистых условиях существенно повышается его гемосовместимость. Радиационносшитый поливинилметил-силоксан использован для изготовления тонких мембран для получения лекарственных препаратов (например, левоноргистрел). Радиационное сшивание транс-1,4-полиизопрена использовано для создания термоусадочных материалов для связывания крупных кровеносных сосудов. Материалы прошли широкие испытания in vitro и in vivo(на собаках). Радиационное модифицирование позволяет улучшить свойства медицинских протезов на основе полиолефинов. С использованием радиационного сшивания получены также полимерные биоматериалы, обладающие повышенной адгезией к коже человека. В Израиле налажен выпуск синтетического перевязочного материала, получаемого путем радиационной прививки гидрофильных мономеров на полиуретан. Материал водонепроницаем, прозрачен, хорошо прикрепляется к коже и пропускает лекарства. Материал выпускается под названием «Омидерм». Разработаны методы получения искусственной роговой оболочки и контактных линз с высокой набухаемостью в воде на основе радиационно-сшитого поливинилового спирта с добавкой хондроитинсульфата натрия. Для существенного повышения проницаемости контактных линз по кислороду предложено облучать их ускоренными тяжелыми ионами массой 2-100 а.е.м. С использованием радиационной полимеризации созданы гидро-гелевые материалы для мягких контактных линз. Эти материалы производятся в КНР. Для создания офтальмологических материалов нашел применение радиационно-сшитый коллаген, выделенный из склеры глаза животных. Этот материал использован для создания временных аллодренажей при антиглаукоматозных операциях. Несомненно, что в ближайшие годы можно ожидать появления на рынке новых полимерных биоматериалов, полученных с использованием методов радиационной полимеризации.
3. Получение полимерных имплантантов.Технические приемы и методы, которые используются в радиационной полимеризации могут быть применены для получения различного рода имплантантов, главным образом для лечения пораженных участков кожи, а также для создания протезов. Разработаны методы получения имплантантов коллагена путем облучения смеси мономеров или полимеров с коллагеном. Имплантанты хорошо совместимы с кровью и не вызывают воспалений. Имплантанты применяются в хирургии и могут использоваться как субстраты в биотехнологии. Изучены протезы на основе полиэфируретана с радиационно модифицированной внутренней поверхностью. Модифицирование осуществлялось путем радиационной прививки 2-гидрокси-метилакрилата или акриламида на внутреннюю поверхность трубок. Протезы изучались in vivo. Исследованы гистологические и механические свойства протезов. Установлена их повышенная тромборезистентность. Разработан метод модифицирования наполнителей для полимеров, используемых в зубоврачебной технике. Наполнители на основе стеклянных или кварцевых волокон модифицированы радиационной прививкой акриловой кислоты из паровой фазы. Подробно изучены физико-механические свойства смол, содержащих различное количество модифицированного наполнителя. Отмечены преимущества используемого модифицированного наполнителя по сравнению с наполнителем, модифицированным силанами. С использованием облучения смесей глинозема с акриловой кислотой созданы полимерно-керамические материалы для стоматологии. С помощью радиационной прививочной полимеризации созданы имплантанты для лечения кожи на пораженных ожогом участках человеческого тела. Для этой цели обычно используют силиконовый каучук, модифицированный прививкой гидрофильных мономеров или модифицированный вулканизованный натуральный каучук. С использованием радиационной технологии создан метод гидрофилизации силиконовых контактных глазных линз. В результате гидрофилизации краевой угол снижается с 150° до 20°, а эффект гидрофильности сохраняется длительное время. Радиационно-модифицированные полимеры использованы для инициирования роста различных клеток
4. Иммобилизация лекарственных препаратов.В области использования радиационной полимеризации для иммобилизации лекарственных веществ наибольшие успехи достигнуты при иммобилизации противоопухолевых составов в полимерные матрицы. В качестве противоопухолевых веществ используются адриамицин, митомицин-С и 5-фторурацил. В ряде случаев лечение иммобилизованными противоопухолевыми препаратами сочетается с гормонотерапией. Иммобилизованные противоопухолевые вещества, как правило, используются в виде полимерных таблеток или игл, которые вводятся в опухоль. Применение иммобилизованных противоопухолевых препаратов имеет следующие преимущества по сравнению с их введением в виде инъекций или орально: небольшая концентрация лекарственных препаратов в крови, лекарство распределяется непосредственно в небольшой области от введенного препарата. При этом имеет место некроз раковых клеток в пределах 0.5-1 см2 около образца, а диффузия противоопухолевых препаратов прекращается в некрозном слое. Это сводит к минимуму побочные эффекты от применения лекарств. Длительность использования иммобилизованных противоопухолевых препаратов - несколько месяцев. При этом скорость выделения лекарств не изменяется. Такие препараты прошли широкие испытания во многих клиниках Японии. Для иммобилизации противоопухолевых препаратов обычно используют различные сополимеры и композиции полиэтиленгликольметакрилатов с различными полимерами (полистирол, поливинилформаль, полиэтиленгликоль, полиметилметакрилат, полиэтиленоксид). Подчеркивается, что облучение необходимо проводить в бескислородной среде, а доза не должна превышать 10 кГр, в противном случае активность противоопухолевых препаратов существенно снижается Скорость выделения лекарств регулируют введением в полимерную матрицу порообразующего агента или адсорбента (например, активированного угля). Технология использования иммобилизованных противоопухолевых препаратов может быть улучшена за счет варьирования гидрофильно-гидрофобных свойств полимерной матрицы, а также использования биодеградируемых полимеров (полипептиды или полилактиды). В Пастеровском институте (Париж) в рамках программы Международного агенства по атомной энергии (МАГАТЭ) проведены исследования с иммобилизованными моноклональными антителами. Иммобилизация последних осуществлена путем низкотемпературной полимеризации 2-гидроксиэтил-метакрилата. Чувствительность реакций иммобилизованного антитела с антигеном зависит от выбора мономера и его концентрации для создания пористой среды. Важной проблемой является минимизация неспецифических реакций полимерного носителя с антигеном. Для этого необходимо увеличивать гидрофобность полимерной матрицы. Иммобилизованные препараты обычно изготавливаются в виде микросфер или микрокапсул. Для иммобилизации антител используются также микросферы, получаемые полимеризацией акролеина или его сополимеры с 2-гидроксиэтилметакрилатом или метакриловой кислотой. Преимуществом радиационной полимеризации для иммобилизации антител является достаточно высокая чистота получаемого продукта. Эти препараты можно использовать для иммунологического анализа. Проведены исследования по иммобилизации антагониста кальция в предварительно полимеризованный гель поли (2-гидроксиэтилметакрилата). Путем радиационного сшивания геля и добавок метилметакрилата и N-винилпирролидона можно широко варьировать скорость выделения лекарства. Исследована иммобилизация гидрокортизона в гели, полученные радиационной полимеризацией акриловой кислоты. Скорость выделения регулируется дозой облучения и обработкой гелей ацетатом цинка. 5. Иммобилизация компонентов крови.Одной из актуальнейших проблем в настоящее время является создание искусственных кровезаменителей, которые могли бы длительное время храниться при обычных условиях не требуя сложной и дорогой аппаратуры. Одним из наиболее перспективных направлений является иммобилизация различных компонентов крови в полимерные композиции с использованием прежде всего радиационных методов полимеризации. Так гемоглобин был иммобилизован в полимерную матрицу из поли(2-гидроксиэтилметакрилата) с использованием радиационной низкотемпера-турной полимеризации. Особое внимание было уделено выбору оптимальных условий иммобилизации для защиты гемоглобина. Гемоглобин удобен для изучения состояния иммобилизованной молекулы в полимерной матрице, так как он имеет характерное оптическое поглощение. Гемоглобин в мембране подвергался обратимой оксигенации, которая имеет почти то же самое значение, что и в нативном гемоглобине. Описан способ получения полу-синтетической крови на основе иммобилизованного карбоксигемоглобина. В работах для иммобилизации гемоглобина использована радиационная полимеризация фосфолипидов. Фосфолипиды содержали две длинные полимеризуемые октадекадиенильные группы. Искусственные красные кровяные клетки были получены путем капсулирования гемоглобина с использованием радиационной полимеризации бислойных фосфолипидов — липосом. Искусственные кровяные клетки оказались механически стабильными, легко выдерживали замораживание. Кислородный транспорт подобных систем оказался подобен транспорту нативного гемоглобина. Проводились испытания in vivo(мыши), которые указали на биосовместимость таких клеток. 6. Получение «умных» полимеров и их использование для иммобилизации биологически активных веществ.За последние годы все возрастающее значение для медицины и биотехнологии приобретают «умные» полимеры. Так называют полимеры, способные реагировать (сжиматься или набухать) на небольшие изменения во внешней среде (температура, рН, электрическое поле и т.д.). «Умные» полимеры с иммобилизованными БАВ используются для выделения лекарств при определенных условиях, как правило, при заданной температуре или рН. Обычно «умные» полимеры получают традиционными методами, однако в последнее время, для этой цели стала использоваться также радиационная полимеризация. Среди «умных» полимеров наибольшее число публикаций посвящено поли(N-изопропилакриламиду) (поли-N-ИПАА). Данный полимер имеет в воде нижнюю критическую температуру растворения (НКТР) ~32°С, т.е. близкую к температуре человеческого тела. Выше 32°С происходит фазовое разделение, обусловленное конформационным переходом макромолекулы поли-N-ИПАА из рыхлой глобулы в компактный клубок, что сопровождается резким уменьшением размеров макромолекулы. Было изучено поведение гидрогелей, полученных на основе поли(N-изопропилакриламида) и скорость диффузии иммобилизованных в них лекарственных препаратов в условиях имитирующих человеческий организм. Было установлено, что при 370С и рН=1,4 (нормальные условия в желудке человека) происходит медленное выделение иммобилизованных в гидрогель индометацина и амилазы, но при изменении величины рН до 7,4 (условия в кишечнике) выделение лекарств значительно ускоряется. Таким образом, можно создавать лекарственные формы, позволяющие доставлять препарат к пораженному органу без значительных потерь. Другим направлением использования таких “умных” полимеров является создание сигнал-чувствительных систем, состоящих из биосенсора, активатора и резервуара для коррекции нарушений в работе различных органов в организме человека. Так для больных диабетом разрабатываются специальные системы с биосенсором на глюкозу, которые запускаются по принципу включение - выключение для выделения определенных порций инсулина, иммобилизованного в гелях, т.е. работающие по принципу поджелудочной железы.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА Основная литература 1. Сазыкин Ю.О. Биотехнология / Ю.О. Сазыкин, С.Н. Орехов, И.И. Чекалиева // Издательский центр "Академия", М. 2006.-256 с. 2. Фармацевтическая микробиология / под ред.проф. В.А. Галынкина, проф. В.И. Кочеровца.- ЗАО “Арнебия”, 2003г.-320 с. 3. Егорова Т.А. Основы биотехнологии / Т.А. Егорова, С.М. Клунова, Е,А. Живухина // Издательский центр “Академия”, М. 2003.-208 с. 4. Елинов Н.П. Основы биотехнологии. -Издательская фирма "Наука", СПБ, 1995.- 600 с. 5. Глик Б. Молекулярная биотехнология. Принципы и применение / Б.Глик, Дж.Пастернак // - М. “Мир”. 2002.- 590 с.
Дополнительная литература 6. Снициин А.П. Иммобилизованные клетки микроорганизмов / А.П. Снициин, Е.И. Райнииа, В.И. Лозинский,С.Д. Спасов // - М.: Изд-во МГУ, 1994. - 288 с. 7. Иммобилизованные клетки и ферменты. - Пер. с англ./ Под ред. Дж. Вудворта.-М.: Мир, 1988. 8. Краткий терминологический словарь микробиолога-биотехнолога. - М.: Наука, 1989. - 136 с. 9. Саруханов А.В. Оборудование микробиологических производств: Справочник // А.В. Саруханов, В.А. Быков - М.: Колос, 1993. - 384 с. 10. Молекулярные и клеточные аспекты биотехнологии / Под ред. С.Г. Инге-Вечтомова. - Л.: Наука, 1996. - 256 с.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Назовите основные классы ферментных препаратов? 2. Назовите основные источники промышленно значимых ферментов? 3. Что такое поверхностный способ культивирования продуцентов? 4. Что такое глубинный способ культивирования продуцентов? 5. На чем основано ферментативное разделение рацемических смесей? 6. Что такое рибозим? 7. Какой фермент называют иммобилизованным? 8. Назовите основные способы иммобилизации ферментов? 9. Назовите основные типы носителей и материалов для иммобилизации ферментов? 10. В чем преимущество иммобилизованных ферментов перед неиммоблизованными? 11. С чем связана потеря активности ферментов после иммобилизации? 12. В чем преимущество иммобилизованных клеток перед иммоблизованными ферментами? 13. В чем недостатки иммобилизованных клеток перед иммоблизованными ферментами? 14. Что такое «активный ил»? 15. Чем обусловлены особенности конструкции ферментеров работающих с иммобилизованными ферментами и клетками? 16. Какие требования предъявляются к полимерным биоматериалам ? 17. Почему для полимеров медицинского назначения используют радиационный способ полимеризации? 18. Что такое «умные полимеры»?
ТЕСТОВЫЕ ЗАДАНИЯ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|