
|
|
теплотам сгорания компонентов реакции12 [1, стр. 198]. СН3СООН + СН3ОН = СН3СООСН3 + Н2О
Теплоты сгорания также относят обычно к одному молю исходного вещества. Пример.Определить тепловой эффект реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению (СООН)2 + 2СН3ОН = (СООСН3)2 + 2Н2О если мольные теплоты сгорания Решение. Для этой реакции согласно уравнению (33) получаем[11]
Следует заметить, что при таких расчётах ΔН получается как разность больших чисел. Поэтому относительно небольшие погрешности в значениях теплот сгорания могут существенно отразиться на значении Зная теплоту сгорания, легко рассчитать теплоты образования и наоборот. Так, теплоту образования метилового спирта по реакции
можно определить, пользуясь приведенными в термохимических таблицах значениями мольных изобарных теплот образования СО2 и Н2О, выражающих соответственно теплоты сгорания ΔНсгор. графита (-94,05 ккал) и водорода
Расчёт теплового эффекта реакции органических веществ по теплотам сгорания получил широкое распространение. Разумеется, тепловые эффекты реакций между органическими веществами можно рассчитывать и пользуясь теплотами образования. Для многих видов тепловых эффектов и, в частности, для теплот образования и теплот сгорания установлен ряд закономерностей, оказывающих нередко большую помощь при проведении приближённых практических расчётов. Зависимость теплового эффекта реакции от температуры. Дифференцируя по температуре (при постоянном объёме) равенство ΔU = U2 – U1, получаем
Согласно (24):
Следовательно:
где CV,1 – изохорная теплоёмкость системы в начальном состоянии; CV,2 – изохорная теплоёмкость системы в конечном состоянии; ΔCV – изменение в изохорной теплоёмкости системы при переходе её из Например, для реакции (28)
В общем случае
Для процессов, происходящих при постоянном давлении, можно аналогичным путём получить:
Уравнения (35) и (38) выражают один закон (закон Кирхгофа)[12], который может быть сформулирован следующим образом: Температурный коэффициент теплового эффекта процесса равен изменению теплоёмкости системы, происходящему в результате процесса. В рассмотренной форме уравнения (35)и (38) определяют только изменение теплового эффекта с температурой. При ΔС = 0 тепловой эффект не зависит от температуры. В более общем случае, чтобы выразить тепловой эффект, как функцию температуры, надо иметь возможность интегрировать соответствующее уравнение и знать тепловой эффект ΔН1 (или ΔU1) при какой-нибудь температуре Т1 в рассматриваемом интервале температур, чтобы исключить постоянную интегрирования. Часто можно пренебречь изменением самих теплоёмкостей с температурой (например, для небольшого интервала температур) и рассматривать ΔСр как постоянную величину. Тогда, интегрируя уравнение (38) в пределах от Т1 до Т при постоянном давлении, получаем
Аналогичные результаты можно получить, интегрируя уравнение (35)
ЛИТЕРАТУРА 1. Киреев В.А.; Краткий курс физической химии; изд. 4-е, доп. и перераб.; 2. Гордон А., Форд Р.; Спутник химика. Физико-химические свойства, 3. Волков В.А., Вонский Е.В., Кузнецова Г.И.; Выдающиеся химики мира. 4. Кларк Дж.; Иллюстрированная хроника открытий и изобретений с
[1] В химии и химической термодинамике часто применяют и противоположную систему знаков, называемую термохимической, по которой положительной принимается теплота, выделяемая системой в ходе процесса. У нас принято в таких случаях отличать q чертой сверху, так что ; при этом обычно противоположный знак даётся и тепловому эффекту. Пользуясь литературными данными, приходится внимательно следить, какая система знаков принята в данном случае [1, стр. 182]. [2] 1 кал = 4,1840 Дж; 1 Дж = 0,239006 кал [2, стр. 482]. [3]Гесс Герман Иванович (7.VIII.1802-12.CII.1850) - русский химик. [4] Майер, Юлиус Роберт фон (1814-1878). Немецкий физик и врач. [5] Джоуль, Джеймс Прескотт (1818-1889). Английский физик. [6] Гельмгольц, Герман Людвиг Фердинанд фон (1821-1894). [7] Игнорируем незначительный расход энергии, передаваемый в форме теплоты окружающей среде, вследствие неизбежного трения движущихся частей механизмов, сопротивления проводов и пр. [1, стр. 188]. [8] Очевидно, что в общем случае можно представить себе очень большое число различных форм проведения этого процесса. Работа, например, может производиться не только против силы земного тяготения (поднятие груза) или против давления газа, но и против химических сил, как, например, при разложении какого-нибудь вещества путём электролиза и др. [1, стр. 189]. [9] Термостатом называется прибор, в котором можно длительное время поддерживать постоянную температуру [1, стр. 193]. [10] Единственное исключение из этого составляет фосфор. Давно было известно, что белый фосфор является менее устойчивым, чем красный. Однако пока тщательное изучение структуры красного фосфора не показало, что существуют различные формы его, не удавалось получать красный фосфор с всегда одинаковыми свойствами. Поэтому в качестве базисного соединения фосфора при определении теплот образования соединений фосфора до относительно недавнего времени был общепринят белый фосфор. Однако около 40 лет назад было установлено, что наиболее устойчивой в обычных условиях является триклинная форма красного фосфора, обозначаемого Р (V, красн.), и в работах и справочниках с той поры начинают использовать эту форму фосфора в качестве базисной формы при определении теплот образования соединений фосфора. Так как для перехода Р(бел.) → Р(V, красн.) ΔН°298 = - 4,2 ккал/моль, то это приводит к существенному различию значений теплот образования данного соединения в зависимости от формы фосфора, принятой в качестве базисной. Пользуясь этими величинами, необходимо выяснить первоначально, к какой форме фосфора они отнесены. Теплоты образования соединений серы и брома (реже – йода) иногда относят не к основному состоянию этих элементов в конденсированной форме (сера ромбическая, бром жидкий), а к гипотетическому состоянию идеального газа с двухатомными молекулами. Впрочем, такие отступления всегда чётко оговариваются и в оригинальных работах и в справочниках [1, стр. 194]. [11] Для воды теплоту сгорания нужно принять равной нулю, так как она сама является конечным продуктом сгорания. То же относится и к двуокиси углерода, если она входит в уравнение реакции [1, стр. 199]. [12] Кирхгоф, Густав Роберт (1824–1887). Немецкий физик. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

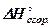 при постоянном давлении до жидкой воды (СООН)2 (крист.), СН3ОН (ж) и (СООСН3)2 (ж) равны соответственно -60,1; -173,65 и -401,0 ккал/моль.
при постоянном давлении до жидкой воды (СООН)2 (крист.), СН3ОН (ж) и (СООСН3)2 (ж) равны соответственно -60,1; -173,65 и -401,0 ккал/моль.
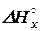 . Так, ошибка в 1% в теплоте сгорания (СООН)2 равна 4 ккал. Для конечного же результата эта ошибка в 4 ккал составляет 60%.
. Так, ошибка в 1% в теплоте сгорания (СООН)2 равна 4 ккал. Для конечного же результата эта ошибка в 4 ккал составляет 60%.
 (34)
(34)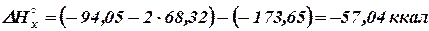
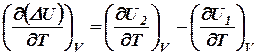

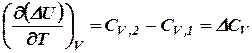 (35)
(35)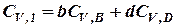
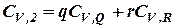
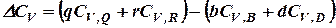 (36)
(36)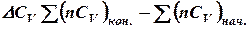 (37)
(37) (38)
(38)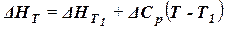 (39)
(39) (40)
(40)