
|
|
Виды сплавов решеток положительного электрода
Отрицательный электрод. Основной процесс, протекающий на отрицательном электроде, описывается уравнением:
Pb +
Потенциал этого равновесия может быть выражен следующим образом:
где Из уравнения (11) следует, что повышение концентрации сульфат-ионов приводит к сдвигу равновесного потенциала в отрицательную сторону. Разряд отрицательного электрода проходит через промежуточную стадию образования ионов Pb2+ (по жидкофазному механизму «растворение – осаждение (кристаллизация)» [3]):
Pb – 2e– → Pb2+, Pb2+ +
Поскольку образующийся в результате разряда сульфат свинца является малорастворимой солью, происходит пассивация поверхности свинца. К тому же сульфат свинца обладает высоким электрическим сопротивлением При заряде отрицательного электрода вначале происходит растворение сульфата свинца, а затем электровосстановление ионов Pb2+. Реакции кристаллизации и растворения резко замедляются при снижении температуры, что наряду с понижением скорости диффузии ионов обуславливает падение разрядной емкости электрода при низких температурах. Саморазряд свинцового электрода определяет в основном саморазряд аккумулятора в целом. Механизм саморазряда отрицательного электрода определяется реакциями:
Pb + H2SO4 = PbSO4 + H2; (12)
Pb + H2SО4 + 1/2O2 = PbSO4 + Н2O. (13)
Известно, что реакция выделения водорода на свинце протекает с большим перенапряжением, поэтому скорость этого процесса на чистом металле очень мала. Скорость реакции (13) лимитируется диффузией растворимого в электролите кислорода к поверхности свинцового электрода. Если принять во внимание, что растворимость кислорода снижается с увеличением температуры и концентрации электролита, то составляющая данной реакции в общей доле саморазряда электрода вряд ли играет существенную роль. Вместе с тем, в герметизированных свинцовых аккумуляторах, в которых доступ кислорода с положительного электрода на отрицательный облегчен в результате применения специальных сепараторов, доля этого процесса в общем процессе саморазряда будет возрастать. Саморазрядсвинцового электрода определяется в основном примесями металлов, входящих в состав сплава положительных токоотводов, анодно растворяющихся и осаждающихся электролитически на свинцовом электроде. Практически все примеси, попадающие на отрицательный электрод из анодного сплава или электролита, обладают меньшим перенапряжением выделения водорода, по сравнению с чистым свинцом. Поскольку эти примеси осаждаются преимущественно в поверхностных слоях электрода, то даже небольшое их количество может привести к высокой скорости саморазряда. К таким примесям относятся сурьма, медь, мышьяк, серебро, висмут и др. Поскольку поверхность губчатого свинца постепенно закрывается кристаллами сульфата свинца, то и скорость саморазряда свинцового электрода постоянно уменьшается. Скорость саморазряда возрастает с увеличением температуры и концентрации электролита. Существенное влияние на саморазряд отрицательного электрода играет хлор. На отрицательном электроде возможен следующий процесс:
Рb + С12 → PbCl2. (14)
Таким образом, саморазряд свинцово-кислотного аккумулятора составляет до 20% в месяц при температуре 20оС. Для снижения саморазряда свинцовых аккумуляторов применяют поверхностно-активные ингибиторы. Действие ингибиторов сводится к повышению перенапряжения выделения водорода на свинце и металлических примесях, накапливающихся на электроде в процессе эксплуатации аккумуляторов. Адсорбируясь на примесях, ингибиторы тормозят катодный процесс выделения водорода. Введение α-нафтола в электролит аккумуляторов позволяет в 2 Депассиваторы (расширители) свинцового электрода. В процессе эксплуатации свинцового аккумулятора происходит так называемая усадка или спекание губчатого свинца. Усадка губчатого свинца приводит к возрастанию истинной плотности тока при разряде, что сокращает разрядную емкость свинцового электрода. Для борьбы с этим нежелательным явлением используютдепассиваторы, которые, как правило, состоят из неорганических солей (в основном сульфата бария) и поверхностно-активных веществ (ПАВ). Органические добавки-расширители, адсорбируясь на свинце, вызывают противоусадочный эффект. В присутствии добавок ПАВ увеличиваются пористость пленки PbSO4 и ее толщина, что обеспечивает увеличение разрядной емкости. К наиболее распространенным расширителям, нашедшим широкое промышленное применение, относятся: гуминовые кислоты, дубители (Дубитель № 4, Дубитель БНФ, ГКД), лигнины. Предлагаются новые расширители на основе сульфата бария (20 Сульфатация отрицательных электродов является одной из основных причин преждевременного выхода из строя свинцовых аккумуляторов. Под сульфатациейпонимается такое состояние электродов с плотным слоем сульфата свинца, при котором их емкость не восстанавливается при заряде. Основными признаками сульфатации пластин являются: снижение номинальной плотности электролита, повышенное напряжение при заряде, обильное газовыделение, появление в электролите взвешенных частиц серого цвета (мелких кристаллов сульфата свинца), создающих «пену». Сульфатация отрицательных электродов происходит по следующим причинам: длительное хранение аккумулятора в разряженном состоянии, систематические недозаряды аккумуляторов, повышенные плотность и температура электролита, короткие замыкания, загрязнение электролита. Известно несколько методов восстановления засульфатированных электродов, прежде всего это замена аккумуляторного электролита на дистиллированную воду и проведение заряда малыми токами. Электролит.Электролитом в свинцовых аккумуляторах служат 28 Электролит для стационарных аккумуляторов и аккумуляторов специального назначения готовят из серной кислоты марки «ч» и дистиллированной воды. Номинальная концентрация электролита выбирается для каждого типа аккумулятора с учетом ряда факторов. Учитывая, что в свинцовом аккумуляторе электролит является расходуемым компонентом (на 1 А·ч расходуется 3,66 г H2SO4), его номинальную плотность выбирают такой, чтобы общий запас электролита не ограничил получение требуемой емкости на длительных режимах разряда. При глубоких разрядах конечная плотность электролита достигает 1,02 Повышенная плотность электролита приводит к сокращению срока службы свинцовых аккумуляторов вследствие пассивации электродов. Для расчета плотности электролита при разных температурах используют формулу:
где
При заряде и разряде аккумуляторов одновременно с изменением концентрации электролита происходит также изменение его объема. При разряде на каждый 1 А·ч емкости объем электролита уменьшается примерно на 1 см3, а при заряде его объем увеличивается. Для герметизированных (безуходных) аккумуляторов используется загущенный (гелеобразный) электролит. Для загущения электролита применяется высокодисперсный диоксид кремния. Иногда при приготовлении электролита в него вводят активирующие добавки. Сепаратор. Сепаратор, наряду с функцией разделителя, фиксирующего межэлектродное расстояние, создает определенный запас кислоты в аккумуляторе, препятствует чрезмерному разбуханию отрицательных электродов, уменьшает «оплывание» положительной активной массы. Находясь между электродами, сепараторы создают внутри аккумулятора дополнительное внутреннее сопротивление, на долю которого приходится 3–15%. Конструкции современных сепараторов имеют ребра жесткости с двух сторон (сепаратор с мультиребром) или гофрированную поверхность типа «вафли». Сепаратор с таким профилем создает запас свободного электролита у поверхности электродов, что улучшает конвективное перемешивание в приэлектродных зонах, а также облегчает выход пузырьков водорода вдоль поверхности отрицательных электродов [1]. Типы сепараторов, используемых в свинцово-кислотных аккумуляторах, приведены в таблице 2 [1]. Основное преимущество стекловолокнистых сепараторов заключается в том, что они предотвращают «оплывание» положительной активной массы. Взаимное расположение сепараторов и электродов, а также последовательность сборки аккумулятора, представлено на рис. 2. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 активная масса;
- олово снижает образование трещин при отливке токоотводов.
активная масса;
- олово снижает образование трещин при отливке токоотводов.
 = PbSO4 + H+ + 2e–. (10)
= PbSO4 + H+ + 2e–. (10) ,(11)
,(11) = – 0,1237 В.
= – 0,1237 В.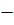 до10 Ом·м).
до10 Ом·м). , (15)
, (15)

 – температурный коэффициент, который в интервале температур 10−30oС составляет 0,0007(г/см3)/°С для раствора плотностью 1,22 г/см3.
– температурный коэффициент, который в интервале температур 10−30oС составляет 0,0007(г/см3)/°С для раствора плотностью 1,22 г/см3.