
|
|
Солевые марганцево-цинковые элементы.ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА РАЗЛИЧНЫХ ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ Лабораторная работа №1 МАРГАНЦЕВО-ЦИНКОВЫЕ СОЛЕВЫЕ И ЩЕЛОЧНЫЕ ЭЛЕМЕНТЫ Первичные марганцево-цинковые (МЦ) элементы являются наиболее распространенными химическими источниками тока. В зависимости от состава электролита и pH марганцево-цинковые элементы делят на солевые и щелочные. В солевых МЦ элементах использована электрохимическая система Лекланше, разработанная еще в 1865 году. Марганцево-цинковые элементы с щелочным электролитом начали выпускать в 50-х годах прошлого века, а с 60-х годов началось их коммерческое производство. С тех пор они постепенно вытесняют солевые элементы. Это обусловлено их преимуществами по сравнению с МЦ элементами с солевым электролитом: более высокой удельной энергией; большими разрядными токами; более низким внутренним сопротивлением; более пологой разрядной кривой; способностью разряжаться при более низких температурах; лучшей сохраняемостью и меньшей вероятностью протечки электролита. Особенно заметно преимущество щелочных ХИТ при непрерывном разряде большими токами. Здесь они существенно выигрывают по такому важному показателю, как стоимость отдаваемой единицы емкости, несмотря на то, что их стоимость (за одно изделие того же типоразмера) в 2–4 раза выше солевого варианта. Тем не менее, и сегодня солевые МЦ элементы – одни из самых массовых изделий (мировое производство составляет больше 20 миллиардов штук в год), а их конструкция практически не изменилась с момента изобретения. Благодаря невысокой цене солевые батарейки используются в различных средствах связи, транзисторных радиоприемниках, магнитофонах, магнитолах, плеерах, пультах дистанционного управления, фотовспышках, фонарях и светильниках, электрочасах, электробритвах, ручных пылесосах, калькуляторах, тестерах, электроигрушках, датчиках охранной сигнализации и других устройствах с относительно небольшим потреблением энергии и продолжительным сроком службы. Элементы с щелочным электролитом применяются в основном в аппаратуре, требующей длительных непрерывных разрядов большими и средними токами. Из бытовой электроаппаратуры, можно назвать кинокамеры, мощные транзисторные приемники и магнитофоны, плееры, фотовспышки, электробритвы, электромеханические часы, ручные пылесосы, электрические игры и игрушки и т.п. Щелочные МЦ элементы также применяются в аппаратуре связи, электроизмерительных приборах, осветительных устройствах, морских хронометрах, дозиметрах, устройствах дистанционного управления, видеокамерах, различных датчиках и т.п. Они находят применение в офисной технике – электронных записных книжках, калькуляторах, факсах и копировальных машинах. Щелочные МЦ элементы могут быть перезаряжаемыми, выдерживая до 50 разрядно-зарядных циклов. В России МЦ элементы выпускают: ОАО «Энергия», АО «Востсибэлемент», АООТ «Кузбасс-элемент», ГНПП «Квант», «АО «Сигнал». За рубежом МЦ элементы выпускают фирмы: «Berec», «Varta» (Германия), «Hitachi Maxell», «National», «Matsushita Electric Industrial», «Sony» , «Sanyo Electric», «Toshiba Battery» (Япония), «Samsung» (Корея), «Golden Peak International», «Hi Power», «Hi Watt» (Китай – Гонконг), «Golden Power», «Hi Top» и др. (Китай), «Samsung Batteries» (Южная Корея).
Солевые марганцево-цинковые элементы. Электрохимическая система марганцево-цинкового элемента с солевым электролитом:
Активным материалом катода МЦ элемента является диоксид марганца (пиролюзит), а анодом – металлический цинк. В качестве электролита применяют водный раствор хлорида аммония с добавлением других солей и загустителя (например, крахмала или муки). В элементах некоторых типов в состав электролита входит также CaCl2. Надпись «High power» на некоторых солевых батарейках означает, что в качестве электролита в них используют чистый хлорид цинка вместо смеси его с хлоридом аммония. Состав электролитов, используемых в производстве МЦ элементов, колеблется в пределах: 4–23 масс.% NH4Cl, до 32% ZnCl2 и до 27% CaCl2. Хлорид аммония принимает участие в токообразующих реакциях, обеспечивает ионную проводимость электролита и стабилизирует рН электролита при небольших токах разряда. Хлорид цинка ускоряет загустевание электролита, обладает буферными и бактерицидными свойствами. Для снижения температуры замерзания электролита в его состав вводят хлорид кальция. Иногда дополнительно вводят бихромат калия и сульфат хрома для предотвращения разжижения электролита при повышении температуры. Из-за гидролиза этих солей электролит имеет слабокислую реакцию (pH ~5). Работа положительного электрода. В качестве положительного электрода в элементах применяется диоксид марганца четырех типов: природный пиролюзит, активированный диоксид марганца (ГАП), электролитический диоксид марганца (ЭДМ) и искусственный или химический диоксид марганца (ИДМ, ХДМ). Не смотря на то, что диоксид марганца является соединением переменного состава MnOn, где n = 1,7–2, в дальнейшем для упрощения будем обозначать его как MnO2. Для увеличения электропроводности диоксида марганца в состав катода вводится чешуйчатый графит или ацетиленовая сажа 8–20 масс.%. Наиболее дешевым и стабильным материалом является пиролюзит β-MnO2 (природная руда, в которой массовая доля MnO2 составляет 85–90%), но он наименее активный, имеет невысокую удельную площадь поверхности (8–10 м2/г). Активированный диоксид марганца получают прокаливанием пиролюзита с дальнейшей обработкой серной кислотой. Он представляет собой γ-MnO2, имеет более развитую поверхность (15–35 м2/г) и более положительный (на 0,15–0,2 В) потенциал, чем природный пиролюзит [1]. Электролитический диоксид марганца (ЭДМ) осаждают на аноде при электролизе раствора сульфата марганца, получаемого, в свою очередь, растворением в серной кислоте продукта обжига бедных природных марганцевых руд. Он так же представляет собой γ-MnO2 и характеризуется высокой удельной площадью поверхности (28–45 м2/г) и активностью. Продукт, получаемый на титановых анодах, отличается существенно более высокими характеристиками, чем полученный на свинцовых анодах. Содержание диоксида марганца в ЭДМ более 90% (табл. 1), плотность 4,4–4,5 г/см3 [1].
Таблица 1 Типичный состав ЭДМ
Примечание * ppm – часть на миллион (10-4%).
Искусственный или химический диоксид марганца производят термическим разложением перманганатов. Он представляет собой η-MnO2. Особенностью ИДМ, как и ЭДМ, является наличие воды в их структуре, что облегчает перенос протона при реакции и повышает активность электрода. Элементы, в которых используется ИДМ, при небольшой плотности тока разряда имеют пологую разрядную кривую. На катоде при восстановлении MnO2 в слабокислой среде (рН≤5) первоначально образуются ионы Mn2+:
MnO2 + 4H+ + 2e– → Mn2+ + 2H2O, E° = 1,23 В. (1)
Реакция сопровождается увеличением pH в прикатодном слое. В нейтральной и щелочной средах ионы Mn2+ неустойчивы и при взаимодействии с MnO2 образуют манганит:
MnO2 + Mn2+ + 2H2O ↔ 2MnOOH + OH–. (2)
Суммарная реакция запишется как
MnO2 + H2O + e– → MnOOH + OH–, E° = 0,35 В. (3)
В нейтральных и щелочных растворах восстановление MnO2 протекает в твердой фазе без перехода ионов марганца в раствор. При разряде происходит непрерывное изменение состава в кристаллической решетке – замена части ионов O-2 на ионы OH–, что возможно благодаря близости параметров решеток MnO2 и MnOOH:
Протоны, отщепляясь от молекул воды, поглощаются твердой фазой оксида, а электровосстановление марганца происходит непосредственно в узлах кристаллической решетки. Изменение степени окисления марганца можно трактовать как образование твердого раствора переменного состава yMnOOH·(1 – y) MnO2, (у – содержание MnOOH, доли единицы). По мере разряда активность MnO2 в поверхностных слоях зерен оксида снижается, что приводит согласно уравнению Нернста к уменьшению равновесного потенциала электрода (Eр, В):
где E° – стандарный потенциал, В, ai – активность вещества. Невысокая буферная емкость слабокислых и нейтральных растворов приводит к резкому увеличению aOH– в прикатодном слое (рН ~ 8–10) и к дополнительному снижению потенциала [2]. Обычно марганцево-цинковые элементы эксплуатируют в прерывистом режиме разряда. В период бездействия за счет диффузионных процессов происходит выравнивание концентрации МnО2 в зернах активного вещества. Движущей силой диффузии является градиент концентрации (по протонам) между наружной и внутренней частью зерна. В глубине зерна
МnO2 + Н+ + е– → МnООН, (6)
в поверхностном слое
МnООН – Н+ − е– → МnO2. (7)
Вследствие выравнивания концентрации МnО2 частично восстанавливается потенциал катода и повышается напряжение ХИТ после периода бездействия (рисунок 1). При отключении ХИТ напряжение в первый момент резко увеличивается (участок ab), что связано со скачком омической составляющей напряжения. После этого напряжение медленно увеличивается (участок bd), что вызвано выравниванием окислительности марганца внутри твердой фазы.
Рис.1. Разрядная кривая МЦ элемента; изменение НРЦ после отключения нагрузки
При прерывистом разряде за счет снижения диффузионной поляризации внутреннее сопротивление электролита ниже, чем его сопротивление при непрерывном разряде. Работа отрицательного электрода. Отрицательный электрод изготавливается из цинка марки Ц0, Ц1, (массовая доля цинка 99,94% и выше). Цинк содержит небольшое количество свинца, галлия или кадмия (десятые или сотые доли процента), которые являются ингибиторами коррозии цинка. Первичным продуктом анодной реакции являются ионы цинка Zn2+:
Zn – 2е– → Zn2+ . (8)
Диффундируя в объем электролита и далее к катоду, ионы Zn2+ вступают в химические реакции с образованием труднорастворимых соединений. При концентрации NH4C1 свыше 7−10 масс.% в основном образуется хлорид диамминоцинка:
Zn2+ + 2NH4C1 ↔ [Zn(NH3)2 ]Cl2↓ + 2H+. (9)
По мере уменьшения концентрации NH4C1 все большую роль играет реакция гидролиза, протекающая в зоне с повышенным рН и приводящая к осаждению оксихлоридов:
5Zn2+ + 8Н2O + 2Cl– ↔ ZnCl2·4Zn(OH)2↓+ 8H+. (10)
Таким образом, с учетом приведенных выше реакций суммарные токообразующие реакции в МЦ элементов с солевым электролитом могут быть условно записаны в следующем виде:
Zn + 2МnO2 + 2NH4C1 → [Zn(NH3)2 ]Cl2+ 2MnOOH; (11)
4Zn + ZnCl2 + 8MnO2+ 8H2O → ZnCl2·4Zn(OH)2 + 8MnOOH. (12)
При работе солевых источников тока помимо образования хлорида диамминоцинка и оксихлорида цинка возможно также осаждение трудно-растворимого гетеролита:
Zn2+ + 2MnOOH ↔ ZnO·Мn2O3↓ + 2H+. (13)
Образование труднорастворимых соединений приводит к частичному экранированию поверхности электродов и к увеличению внутреннего сопротивления марганцево-цинковых ХИТ. Для МЦ элементов с солевым электролитом характерен значительный саморазряд (до 30% в год), обусловленный взаимодействием цинкового электрода с хлоридом аммония, водой и растворенным кислородом с последующим образованием труднорастворимых пассивных пленок на электроде:
Zn + 2NH4C1 → [Zn(NH3)2 ]Cl2 + H2; (14)
Zn + 2H2O → Zn(OH)2 + H2; (15)
2Zn +O2 + 2H2O → 2Zn(OH)2. (16)
По мере расходования растворенного кислорода в электролит поступают новые порции кислорода, образующегося при саморазряде катода, который протекает с очень малой скоростью:
2МnO2 + Н2O + С → С(Оадс) + 2МnООН; (17)
2МnO2 + Н2O → ½ O2+ 2МnООН. (18)
Для снижения скорости коррозии в состав электролита ранее вводили сулему (хлорид ртути HgCl2), при взаимодействии с которой происходит амальгамирование цинка, т. е. покрытие поверхности слоем сплава цинк-ртуть, что приводит к увеличению перенапряжения реакции выделения водорода. В настоящее время большинство стран в законодательном порядке ограничили или запретили использование ртути в составе МЦ элементов. Одной из последних стран, принявших такие ограничения, является Китай, в котором с января 2001 г., запрещен выпуск элементов, содержащих более 0,025 % (по массе) ртути [1]. В России содержание ртути в выпускаемых и эксплуатируемых МЦ ХИТ не регламентировано. Другим способом снижения коррозии и, как следствие, увеличения сохраняемости, является повышение чистоты использумых материалов, а также применение нетоксичных органических ингибиторов коррозии (в электролите) и свинца или других металлов в аноде. Это привело к возможности выпуска экологически безопасных («зеленых») МЦ элементов.
Щелочные марганцево-цинковые элементы. Электрохимическая система элемента с щелочным электролитом:
В качестве электролита используются концентрированные растворы КОН (иногда NaOH) c добавками ZnO, а иногда и LiOH. Электролит загущен природными или синтетическими полимерными соединениями, содержащими ОН-группы. Разряд диоксидно-марганцевого электрода в щелочных растворах рассмотрен выше. Потенциал электрода более стабилен вследствие высоких буферных свойств щелочного электролита. В концентрированном растворе щелочи манганит может растворяться с образованием тетрагидроксоманганит(III)-иона [
[Mn(OH)4]– + e– → Mn(OH)2 + 2OH–. (19)
Активным материалом анода является порошкообразный цинк высокой степени чистоты, содержащий незначительное количество примесей, включая свинец. Свинец является ингибитором коррозии цинка. Для снижения скорости коррозии цинк может быть также легирован небольшими добавками индия, висмута и алюминия. Скорость коррозии цинка заметно возрастает при увеличении содержания в нем железа, поэтому очень важно снижать долю железа до минимального уровня. Средний диаметр частиц цинка – в пределах 155–255 мкм, удельная поверхность составляет порядка 0,02 м2/г. Активная масса анода содержит цинк (объемная доля 18–33%), загуститель (гель-компонент), раствор электролита, оксид цинка и ингибитор коррозии. В качестве гель-компонента применяют производные целлюлозы, полиакрилаты, поливиниловый спирт и другие полимеры. Работа цинкового электрода в щелочных электролитах отличается рядом особенностей. В избытке щелочи в результате анодной реакции (так называемого первичного процесса) образуется цинкат калия, имеющий хорошую растворимость (до 1–2 моль/л):
Zn + 4OH– → [Zn(OH)4]2– + 2е–, E° = –1,216 B. (20)
После достижения концентрации насыщенного по цинкату раствора начинается его распад с выделением в осадок гидроксида и оксида цинка, так как растворимость ZnO в щелочи примернов 2 раза ниже растворимости Zn(OH)2:
[Zn(OH)4]2– → Zn(OH)2 + 2OH–; (21) [Zn(OH)4]2– → ZnO + Н2O + 2OH–. (22)
В насыщенном цинкатном растворе анодная реакция будет протекать по следующему уравнению (вторичный процесс):
Zn + 2ОН– → Zn(OH)2 + 2е–, Е° = –1,245 В. (23) Zn + 2ОН– → ZnO + Н2O + 2е–. (24)
Если ионизация цинка идет по вторичному процессу, то расход щелочи уменьшается в два раза по сравнению с первичным процессом. Однако реакция (24) сопровождается образованием труднорастворимого соединения, поэтому цинковый анод склонен к пассивации; использование гладкого анода возможно лишь при малых плотностях тока. Применение порошкового цинкового электрода с развитой поверхностью позволяет вести разряд при высоких габаритных плотностях тока (около 1 кА/м2). Вводимый в электролит цинкат калия тормозит коррозию цинка, так как цинкат представляет собой продукт коррозионного процесса:
Zn + 2ОН– + 2Н2O → [Zn(OH)4]2– + Н2. (25)
Поэтому саморазряд МЦ элементов с щелочным электролитом не превышает 10% в год. Для дополнительного снижения скорости коррозии в анодную пасту до сих пор иногда вводят оксид ртути, при взаимодействии с которым цинк амальгамируется, что приводит к повышению перенапряжения выделения водорода. В МЦ элементах с щелочным электролитом суммарная токообразующая реакция будет идти без расхода щелочи:
Zn + 2MnO2 + Н2O → 2МnООН + ZnO. (26)

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.
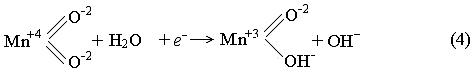
 , (5)
, (5)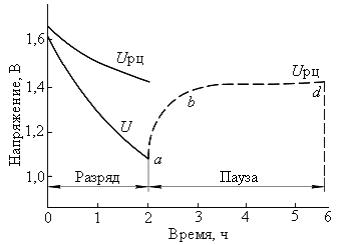
 .
. ]–, который может в дальнейшем восстанавливаться по жидкофазному механизму:
]–, который может в дальнейшем восстанавливаться по жидкофазному механизму: