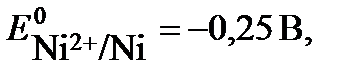|
|
Б. Электролиз насыщенного раствора NaCl c медными электродамиЭЛЕКТРОХИМИЯ
Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов
Нижний Новгород 2012 Составители: О.Н.Ковалева, Ю.В.Батталова, В.К.Османов, А.Д.Самсонова УДК 54 (07)
Электрохимия: метод. указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов / НГТУ им. Р.Е. Алексеева; сост.: О.Н.Ковалева, Ю.В.Батталова, В.К.Османов, А.Д.Самсонова, Н.Новгород, 2012. – 39 с.
В методических указаниях предложены теоретическая часть, вопросы и задачи для домашних и практических занятий, а также описание лабораторных работ по теме «Электрохимия».
Научный редактор В.И. Наумов
Редактор Э.Б.Абросимова
Подп. к печ. 3 .09.2012 Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ. л. 2,5 Уч.-изд. .л. 2 Тираж 1500 экз. Заказ . Нижегородский государственный технический университет. Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный технический университет им.Р.Е.Алексеева, 2012 ЭЛЕКТРОД. СТАНДАРНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Электрод – это металл или другой токопроводящий материал, погруженный в раствор или расплав электролита. Например, цинковая пластина, опущенная в водный раствор сульфата цинка ZnSO4, или медная, - в водный раствор CuSO4 , платина, погруженная в раствор поваренной соли и др. На границе металл-электролит, изображаемой Ме|раствор, возникает разность потенциалов. В частном случае электродов 1-го рода, металл и раствор содержат одинаковые ионы - катионы металла. В металле катионы находятся в узлах кристаллической решетки, а между ними перемещаются свободные электроны, полностью компенсирующие заряд катионов. В растворе ионы металла гидратированы - связаны с молекулами воды.
а б
Рис.1 двойной электрический слой: а) металл заряжен положительно, б) – отрицательно При погружении металлической пластины в раствор ионы металла, расположенные в поверхностном слое, притягивают полярные молекулы воды, вырываются ими из кристаллической решетки и, гидратированные, переходят в раствор. Одновременно под действием сил кристаллической решетки происходит обратный процесс. В зависимости от природы металла и концентрации раствора в момент погружения металла в раствор скорость одного из этих процессов больше, на границе металл-раствор его соли устанавливается равновесие: Me + m H2O ↔Men+∙ mH2O + nē, (1) где Me – атом металла, Men+∙ mH2O – гидратированный ион металла в растворе, n- число электронов ( совпадает с величиной заряда иона). В зависимости от природы металла и концентрации раствора количество катионов, переходящих из металла в раствор, может быть больше или меньше, чем количество катионов, вошедших в кристаллическую решетку. В первом случае создается избыток электронов в металле. Для активных металлов (например, цинк) количество перешедших катионов в раствор больше, чем вошедших в кристаллическую решетку, что создает избыток электронов в металле. Таким образом, металл заряжается отрицательно и притягивает к себе из раствора положительные ионы. На границе металл – раствор образуется так называемый двойной электрический слой (ДЭС). ДЭС можно уподобить плоскому электрическому конденсатору, одной из пластин которого является поверхность металла, другой – раствор электролита (рис.1). Вследствие разделения зарядов в ДЭС между металлом и раствором возникает разность электрических потенциалов, которая не поддается измерению, называется электродным потенциалом. Потенциал, соответствующий состоянию равновесия на поверхности электрода, называется равновесным. Для измерения равновесного потенциала создается гальванический элемент – система из двух электродов. За равновесный (стандартный) электродный потенциал электрода (Е0Ox/Red) принимают ЭДС гальванического элемента, составленного из стандартного водородного электрода и данного электрода. Величина электродного потенциала зависит от химической природы металла, концентрации ионов в растворе, температуры и числа электронов, принимающих участие в электродном процессе. Зависимость равновесного электродного потенциала от указанных выше факторов определяется уравнением Нернста: где E0Ox/Red – равновесный (стандартный) электродный потенциал, В; n – количество эквивалентов металла, совпадающее с числом электронов, участвующих в электродном процессе; R = 8,31 Дж/моль•К – универсальная газовая постоянная; Т – температура, К; F = 96500 Кл/моль – постоянная Фарадея; aOx , aRed – активность окисленной и восстановленной формы в растворе соответственно, моль/л. Для разбавленных растворов активность совпадает с молярной концентрацией а=С; При стандартных условиях (Т= 298К), с учетом численных значений R и F, а также при замене натурального логарифма десятичным, уравнение Нернста принимает вид
где СOx, CRed -концентрация окисленной и восстановленной формы в растворе соотвественно, моль/л.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ Электроды I-го рода. К электродам I-го рода относятся металлические, окислительно-восстановительные (редокс-) и газовые электроды . Металлические электроды описаны выше. Это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Уравнение Нернста для металлических электродов имеет вид:
где Окислительно-восстановительные редокс-электроды – это электроды из инертного металла, играющего роль токоподвода, на поверхности которого протекает окислительно-восстановительная реакция. Например: Fe3+ + ē ↔ Fe2+ Уравнение Нернста для редокс - систем включает концентрацию обоих катионов и имеет вид:
где СOx, CRed– концентрации окисленной и восстановленной формы соответственно, моль/л. К газовым электродам относят электроды, у которых окисленная или восставленная форма находится в газообразном состоянии. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды. Водородный электрод. Водородный электрод состоит из платиновой проволоки, покрытой платиновой чернью (электролитически осажденной платиной) и погруженной в раствор кислоты (рис.2). Через раствор непрерывно пропускается поток водорода, водород «растворяется» на поверхности платины и на границе электрод / раствор устанавливается равновесие: H+(раствор) + ē ↔ ½ H2 (г) . (6) Уравнение Нернста для водородного электрода имеет вид:
где
При давлении водорода, равном 105Па (1 атм), активности (концентрации) ионов водорода СН+ =1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом.
Рис. 2. Стандартный водородный электрод ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ. ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Гальванический элемент – это система, состоящая из двух электродов, в которой за счет окислительно-восстановительных реакций между электродами возникает разность потенциалов. Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления (отдача электронов), на катоде – процесс восстановления (присоединение электронов). Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Границу раздела обозначают вертикальной чертой. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом: (-)Zn|ZnSO4||CuSO4|Cu(+) или (-)Zn|Zn2+||Cu2+|Cu(+) Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами.
Рис. 3. Схема гальванического элемента Даниэля-Якоби Гальванический элемент Даниэля-Якоби представляет собой: цинковую и медную пластину опущенные в 1М растворы своих солей, соединенные электролитическим мостиком. При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции: Анодный процесс Zn – 2e→ Zn2+ реакция окисления Катодный процесс Cu2+ + 2e →Cu реакция восстановления Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток: Zn + Cu2+ = Zn2+ + Cu Такое уравнение называется – уравнением токообразующей реакции. ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек – Еа. ЭДС медно-цинкового элемента В гальваническом элементе электрический ток возникает за счет химической реакции, т.е. химическая энергия в элементе превращается в электрическую. При обратимом изотермо- изобарическом процессе (Т= const, р = const) получаемая электрическая энергия будет наибольшей, а совершаемая системой работа будет иметь максимальное значение, равное убыли энергии Гиббса:
ЭЛЕКТРОЛИЗ. ЗАКОНЫ ФАРАДЕЯ. Окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока от внешнего источника через раствор или расплав электролита, носит название электролиза. Электролиз проводят в электролизерах или электролитических ваннах, заполненных раствором или расплавом электролита. Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подключенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода. Последовательность процессов, протекающих на электродах, определяются свойствами электролита, растворителя и материала электрода. Какие именно процессы будут протекать, прежде всего зависит от соотношения электродных потенциалов соответствующих реакций. Из нескольких альтернативных процессов протекает тот, осуществление которого требует минимальных затрат энергии. Это означает, что на катоде в первую очередь протекают реакции с наибольшим значением электродного потенциала, а на аноде - с наименьшим. Рассматривая процессы электролиза водных растворов, необходимо учитывать возможность участия молекул воды в электродных реакциях: восстановления на катоде (8) и окисления на аноде(9). На катоде: 2H2O + 2e → H2 + 2 OH- (8) На аноде: 2H2O – 4 e Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом. Инертным (нерастворимым) называется анод, материал которого не окисляется в процессе электролиза. К инертным относятся графитовый, угольный, платиновый и др. электроды. Растворимым является анод, материал которого окисляется при прохождении тока. Большинство металлических электродов являются растворимыми. В случае растворимого анода, кроме окисления аниона электролита и молекул воды, возможна реакция окисления материала анода. Напряжение электролиза. Напряжение электролиза (ΔUэл-за) – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. ΔUэл-за = iEа – iEк + ΔUэл-та + iR , (10) где iEа ,iEк - потенциалы анода и катода под током соответственно, ΔUэл-та , iR – падение напряжения при прохождении тока через электролит и внешнюю цепь соответственно. Электролиз процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений на величину ΔЕа и ΔЕк . iEа = рEа + ΔЕа, iEк = рEк + ΔЕк. (11) Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации (ΔЕа и ΔЕк) называется перенапряжением. Сравнение равновесных потенциалов конкурирующих электродных реакций может служить только ориентировочным критерием оценки последовательности разряда частиц при электролизе. Прохождение тока нарушает равновесие, существующее на электродах. Большинство процессов на электродах идут с перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, условия проведения электролиза (плотность тока, температура) и др. Для правильного выбора процессов на электродах необходимо сравнивать не величины равновесных потенциалов возможных полуреакций, а величины потенциалов поляризованных электродов. Процесс образования газов, как правило, протекает с перенапряжением. Рассмотрим процесс электролиза водного раствора хлорида на инертном электроде. На аноде возможны следующие реакции: 2 Cl- - 2 e → Cl2 2H2O – 4 e Потенциал окисления воды дан для кислого раствора (рН=0), с учетом подкисления раствора при электролизе. Согласно величинам стандартных электродных потенциалов на аноде должен выделяться кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока = 1а/м2, что повышает потенциал окисления воды до 2,4 В. I закон Фарадея. Для любого электродного процесса количество вещества, испытывающего превращение в данном электродном процессе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита.
где k – электрохимический эквивалент, г/Кл или г/А•ч, Q – количество электричества, Кулон, F = 96500 Кл/моль ( А•с/моль) = 26,8 А•ч/моль – постоянная Фарадея. II закон Фарадея При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
где m1 и m2 – массы веществ 1 и 2,Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2. На практике часто вследствие протекания параллельных окислительно- восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству, согласно I закону Фарадея. Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Втназывается выраженное в процентах отношение количества, фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор, соответствующему количеству прошедшего электричества: ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ ПРИМЕР 1. Увеличится или уменьшится масса цинковой пластинки при взаимодействии с растворами: а) AgNO3; б) NiSO4. Решение: протекание окислительно-восстановительной реакции возможно, если потенциал окислителя больше потенциала восстановителя Еок-ля > Евосст-ля. В данной задаче восстановителем является цинк, а окислителями – катионы металла: в растворе нитрата серебра – Ag+ , в растворе хлорида никеля - Ni2+. Сравним значения стандартного потенциала цинка Zn + NiSO4 = ZnSO4 + Ni (1) Zn + 2AgNO3 = Zn(NO3)2 + 2 Ag (2) При погружении цинка в растворы NiSO4 и AgNO3, он будет растворяться, но одновременно на его поверхности будет осаждаться никель или серебро. Изменение массы цинковой пластины зависит от соотношения масс перешедшего в раствор цинка и осевшего на нем металла. Согласно реакции (1) при растворении 1 моля цинка на поверхности осаждается 1 моль никеля. Сравним мольные массы металлов. Так как мольная масса никеля (58,9 г/моль) меньше, чем мольная масса цинка (65,4 г/моль), то масса цинковой пластины в растворе NiSO4 уменьшится. Согласно реакции (2) при растворении 1 моля цинка осаждается 2 моль серебра, с мольной массой 107,9 г/моль, следовательно, масса цинковой пластинки в растворе AgNO3 увеличится. ПРИМЕР 2. Вычислить значение электродного потенциала меди, опущенной в раствор соли с концентрацией ионов [Cu2+ ]= 0,001 моль/л. Решение: вычисление электродного потенциала На поверхности меди, опущенной в раствор ее соли, устанавливается равновесие: Сu2+ + 2e ↔ Cu. Подставляем в уравнение Нернста величину стандартного потенциала медного электрода, взятую из таблицы, и концентрацию ионов меди и рассчитываем
ПРИМЕР 3. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором Решение: ЭДС гальванического элемента рассчитывают как разность равновесных потенциалов катода и анода: Е= Ек – Еа. Для определения анода и катода рассчитаем по уравнению Нернста значения электродных потенциалов цинка и свинца, поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л.
электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления: (-) А: Zn – 2 e→ Zn2+ Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления: (+) К: Pb2+ + 2e → Pb Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb. Схема гальванического элемента: (-)Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb(+). Рассчитываем ЭДС гальванического элемента Е= Ек – Еа = При замыкании цепи электроны во внешней цепи пойдут от отрицательного к положительному электроду - от цинка к свинцу. ПРИМЕР 4. Для гальванического элемента Pt│Cr3+(0,1 моль/л), Cr2+(0,01 моль/л)║0,01 моль/лН+│Н2(pH2 = 1 атм),Pt Рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. По какому направлению движутся электроны во внешней цепи? Решение: данный гальванический элемент составлен из окислительно-восстановительного и водородного электродов. Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста: Стандартный потенциал пары Сr3+/Cr2+ Второй электрод данного гальванического элемента является водородным электродом. Потенциал газового водородного электрода, согласно уравнению Нернста, зависит от концентрации (активности) ионов водорода и давления газа водорода в растворе:
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором катодный процесс – восстановления: На аноде Cr2+ - e → Cr3+ На катоде 2 Н+ +2е → Н2. Суммарная токообразующая реакция описывается уравнением 2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2 Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному - от хромового окислительно-восстановительного электрода к водородному. ЭДС данного элемента ПРИМЕР 5. Какие процессы протекают на электродах цинкового концентрационного гальванического элемента, если у одного из электродов концентрация (активность) ионов цинка Zn2+ равна 1 моль/л, у другого – 0,0001 моль/л? Какова ЭДС этого элемента? Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация (активность) ионов цинка у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: Потенциал второго электрода рассчитаем по уравнению Нернста:
Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления Zn2+ + 2e→Zn. Токообразующая реакция в гальваническом элементе будет иметь вид Zn + Zn2+→ Zn + Zn2+ Рассчитываем ЭДС элемента: Е = Ек-Еа = - 0,76 –(-0,88) = 0,12 В Данный гальванический элемент можно отобразить схемой: (-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn(+) ПРИМЕР 6. Константа равновесия реакции, протекающей в гальваническом элементе (-)Zn│Zn2+║Cd2+│Cd(+), равна 1,597•1012. Определите электродный потенциал кадмия, если электродный потенциал цинка Решение: в данном гальваническом элементе протекает реакция Zn + Cd2+ = Zn2+ + Cd. Между константой равновесия реакции, протекающей в гальваническом элементе и ЭДС элемента, существует зависимость: Для данного элемента Отсюда потенциал кадмиевого электрода составит ПРИМЕР 7. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие процессы изменятся, если угольный электрод заменить на медный? Решение: в растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным. На катоде возможны следующие процессы восстановления: Na+ + e → Na 2H2O + 2e → H2 + 2 OH- Потенциал восстановления молекул воды(-0,82В) дан для щелочного раствора, с учетом подщелачивания среды в ходе электролиза. Сравнивая потенциалы катодных реакций, видим, что потенциал восстановления воды наибольший, что соответствует их большей окислительной способности. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в катодном пространстве гидроксид ионов ОН-. Ионы натрия Na+, приходящие к катоду, будут накапливаться у электрода. На аноде возможны следующие реакции: 2 SO42- - 2e → S2O82- 2 H2O - 4 e → 4H+ + O2 Окисление молекул воды идет при меньшем потенциале, следовательно, они обладают большей восстановительной способностью. Поэтому на аноде будет происходить окисление молекул воды с выделением кислорода и образованием кислой среды (ионов водорода Н+). Ионы SO42- будут накапливаться в анодном пространстве. Таким образом, при электролизе раствора сульфата натрия с угольным инертным анодом в электродных процессах участвуют только молекулы воды. В близи катода ионы Na+ и OH- образуют раствор щелочи NaOH,а у анода ионы H+ и SO42- – раствор серной кислоты. Суммарная реакция электролиза выражается уравнением: 2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4. у катода у анода При замене инертного (угольного) анода на медный, на аноде становиться возможным протекание еще одной реакции окисления – растворение меди: Cu – 2 e → Cu2+ Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарное уравнение реакции электролиза выразится уравнением: Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4. у катода у анода
ПРИМЕР 8. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом. Решение: на катоде возможны следующие реакции: Ni2+ + 2e → Ni 2H2O + 2e → H2 + 2 OH- Большинство процессов при электролизе идет с перенапряжением, особенно образование газов (H2, O2 и др.). Пренебрежение величиной перенапряжения полуреакций может привести к неправильному определению природы электродного процесса. Возможные анодные реакции: 2 Cl- - 2 e → Cl2 2H2O – 4 e Потенциал окисления воды дан для кислого раствора (рН =0), с учетом подкисления раствора при электролизе. Согласно величинам стандартных электродных потенциалов, на аноде должен выделятся кислород. В действительности на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода η0 = 1,17 В, что повышает потенциал окисления воды до 2,4 В. Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора: Ni2+ + 2Cl- = Ni + Cl2. у катода у анода ПРИМЕР 9. При электролизе водного раствора нитрата серебра AgNO3 с нерастворимым анодом в течение 25 мин, с силой тока 3 А на катоде выделилось 4,8 г серебра. Рассчитайте выход по току серебра. Какой процесс протекает на аноде? Решение. При электролизе водного раствора нитрата серебра AgNO3 в случае применения нерастворимого анода (например, графитового) на электродах протекают процессы: (-) К Ag+ + e → Ag 2H2O + 2e → H2 + 2OH- Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра. (+) A 2H2O – 4 e анион NO3- не окисляем. Суммарное уравнение электролиза нитрата серебра AgNO3: 2 AgNO3 + 2H2O = 2Ag + O2 + 4HNO3 у катода у анода По первому закону Фарадея масса вещества, образующегося при электролизе , прямо пропорциональна количеству пропущенного через раствор электричества Q: Эквивалентная масса cеребра ЭAg = 109 г/моль, постоянная Фарадея F = 26,8 А•ч/моль. Определяем mтеор: ПРИМЕР 10. Рассчитайте силу тока при электролизе раствора, если на катоде в течение 1 ч 40 мин выделилось 1,4 л водорода (н.у.). Решение. Согласно закону Фарадея ПРИМЕР 11. Рассчитайте значение теоретического напряжения разложения водного раствора сульфата никеля NiSO4 при электролизе на платиновых электродах. Решение: рассчитать теоретическое напряжения разложения электролита, это значит определить разность потенциалов анодного и катодного процессов, протекающих на электродах: Eн.р.= Еа – Ек . Платиновые электроды относятся к инертным электродам. При электролизе раствора NiSO4 на катоде выделяется никель, а на аноде – кислород: (-) К Ni2+ + 2e → Ni (+) A 2H2O – 4 e Суммарное уравнение электролиза: 2NiSO4 + 2H2O → 2Ni + O2 + 2H2SO4 Теоретическое напряжение разложения Практическое напряжение разложения выше теоретического за счет перенапряжения выделения продуктов электролиза. ВОПРОСЫ И ЗАДАНИЯ 1. Какие из перечисленных ионов Al3+, V2+, Pb2+, H+, Cu2+могут быть восстановлены железом из водных растворов? 2. а) никелевая пластинка внесена в раствор соли трехвалентного хрома. Возможно ли растворение никеля и выделение хрома? б) хромовая пластина внесена в раствор соли никеля. Возможно ли растворение хрома и выделение никеля? 3. Возможно ли вытеснение хромом цинка из раствора его соли? Возможно ли вытеснение цинком хрома из раствора его соли? 4. Будет ли реагировать металлический цинк с растворами: а) NaCl; б) MgSO4; в) СuSO4; г) Hg(NO3)2? Написать уравнения протекающих реакций. 5. В 1 М растворы HCl, CuSO4, Pb(NO3)2, Al2(SO4)3, KNO3, NiSO4опускают по кусочку олова. В каком растворе олово будет растворяться? 6. Какие металлы будут выделяться, если кадмиевая пластинка опущена в раствор, содержащий одновременно MnSO4, NiSO4, NaCl, AgNO3cодинаковой концентрацией катионов? 7. Из каких солей металл может быть вытеснен никелем: Pb(NO3)2, Al2(SO4)3, CuSO4, AgNO3, ZnSO4? 8. Какие металлы будут выделяться на а) Fe- пластине; б) Ni- пластине, если они опущены в растворы солей с одинаковой концентрацией катионов: NaCl, MnSO4, CuSO4, ZnSO4, MgCl2, AgNO3? 9. Какие металлы будут выделяться, если марганцевая пластинка опущена в растворы солей с одинаковой концентрацией катионов: FeSO4, MgCl2, ZnSO4, Hg(NO3)2? 10. Никелевые пластинки опущены в растворы: Pb(NO3)2, MgSO4, NaCl, CuSO4, AlCl3, ZnCl2. С какими солями цинк будет реагировать? Напишите уравнения реакций в молекулярной и ионной форме. 11. В шесть пробирок налиты растворы: MgSO4, HgCl2, CuSO4, Al2(SO4)3, AgNO3, SnCl2. В каждую брошено по кусочку цинка. В каких пробирках произошли реакции? Выразите их молекулярными и ионными уравнениями. 12. Какие из перечисленных ниже взятых попарно веществ будут взаимодействовать друг с другом? Fe+HCl; Cu+ HCl; Hg+ AgNO3; Zn+ MnSO4; Mg+ NiCl2. Выразите протекающие реакции молекулярными и ионными уравнениями. 13. Между какими из перечисленных ниже взятых попарно веществ пойдет реакция замещения? Ag+ HF; Cu+ HgCl2; Zn+ MgCl2; Sn+ HCl; Hg+ HCl; Zn+ AgNO3. 14. Три свинцовых пластинки опустили в растворы: а) CuSO4; б) Zn(NO3)2; в) HNO3(разб.). Что произойдет в каждом случае с массой пластинки? Ответ поясните с помощью химических реакций. 15. Три пластинки из железа погружали соответственно в растворы: а) CuSO4; б) Pb(NO3)2; в) ZnSO4. Как изменится масса пластинок после взаимодействия их с растворами? 16. Увеличится или уменьшится масса цинковой пластинки при взаимодействии с растворами: а) CuSO4; б) Pb(NO3)2 ? 17. Увеличится или уменьшится масса железной пластинки после выдерживания ее в растворе: а) Na2SO4; б) NiSO4; в) AgNO3? 18. В два сосуда с голубым раствором медного купороса поместили: в первый цинковую пластинку, во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте молекулярные и ионные уравнения реакций. 19. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? 20. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) Pb(NO3)2; б) MgSO4; в) CuSO4? 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
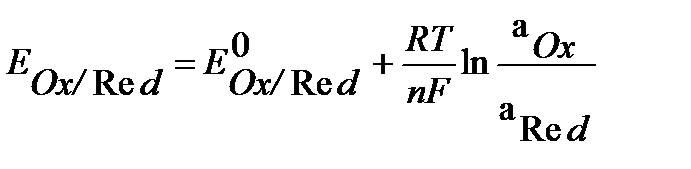 , (2)
, (2) , (3)
, (3)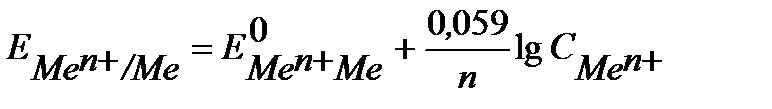 , (4)
, (4) - концентрация ионов металла в растворе, моль/л.
- концентрация ионов металла в растворе, моль/л.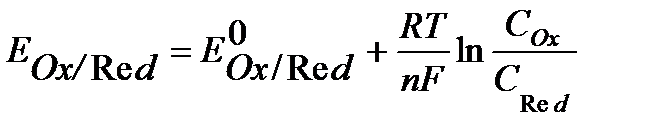 , (5)
, (5) ,
,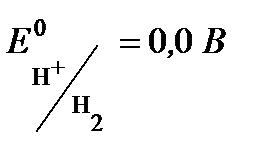 - стандартный электродный потенциал,
- стандартный электродный потенциал, - концентрация ионов водорода в растворе, моль/л
- концентрация ионов водорода в растворе, моль/л -парциальное давление водорода над раствором, атм.
-парциальное давление водорода над раствором, атм.

 .
. (7)
(7) O2 + 4 H+ (9)
O2 + 4 H+ (9)

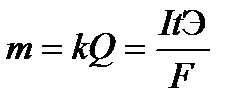 , (12)
, (12)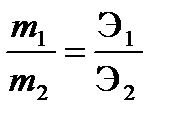 ,
,
 со значениями стандартных потенциалов никеля
со значениями стандартных потенциалов никеля  и серебра
и серебра  . Поскольку потенциал цинка имеет меньшее значение, чем потенциал никеля и серебра, то как более сильный восстановитель будет вытеснять никель и серебро из растворов их солей:
. Поскольку потенциал цинка имеет меньшее значение, чем потенциал никеля и серебра, то как более сильный восстановитель будет вытеснять никель и серебро из растворов их солей: производят по уравнению Нернста. Для медного электрода уравнение Нернста имеет вид:
производят по уравнению Нернста. Для медного электрода уравнение Нернста имеет вид: 

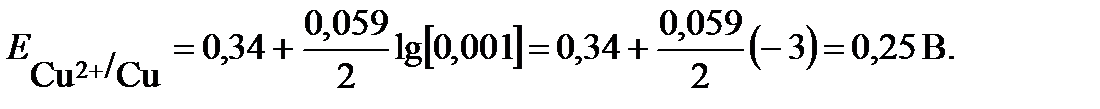

 и
и  . Узнать знаки полюсов, написать уравнения равновесных электродных процессов, составить схему гальванического элемента. Рассмотреть направление процесса при замыкании цепи.
. Узнать знаки полюсов, написать уравнения равновесных электродных процессов, составить схему гальванического элемента. Рассмотреть направление процесса при замыкании цепи.
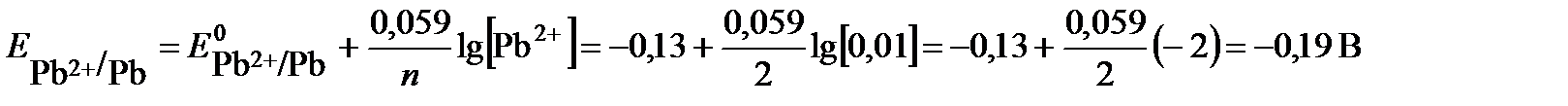
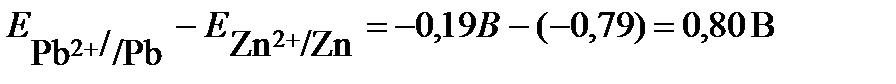
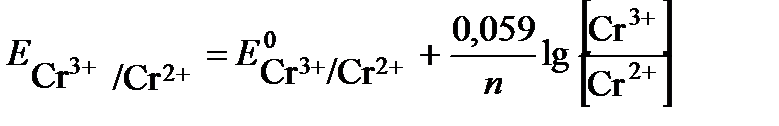
 . Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
. Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:  .
.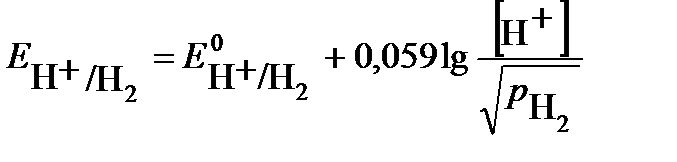 . Учитывая, что потенциал стандартного водородного электрода
. Учитывая, что потенциал стандартного водородного электрода  равен нулю, а давление водорода по условию задачи 1 атм., получим:
равен нулю, а давление водорода по условию задачи 1 атм., получим:  .
.
 .
. Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: Zn -2 e→Zn2+.
Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: Zn -2 e→Zn2+. .
.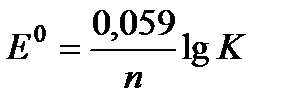 .
. . В тоже время,
. В тоже время,  .
.


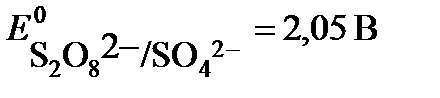
 .
.
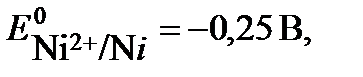
 . Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
. Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.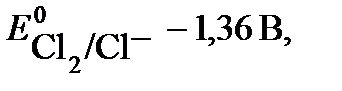
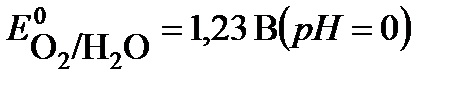
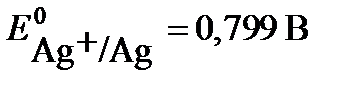 ,
,
 ,
,
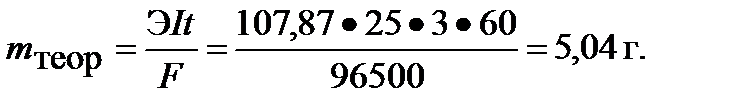 Выход по току
Выход по току 
 .
. Так как количество водорода дано в объемных единицах, то отношение
Так как количество водорода дано в объемных единицах, то отношение  заменяем отношением
заменяем отношением  , где
, где 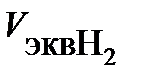 = 11,2 л/моль – эквивалентный объем водорода. Тогда сила тока
= 11,2 л/моль – эквивалентный объем водорода. Тогда сила тока