
|
|
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.12 Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
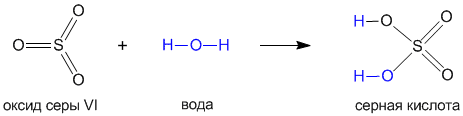
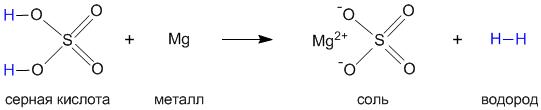
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4.Одно "рождается" из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль). Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода. По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1). Таблица 8-1. Классификация кислот по составу.
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2: Таблица 8-2. Классификация кислот по числу атомов водорода.
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH: HNO3 + NaOH = NaNO3 + H2O HCl + KOH = KCl + H2O Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания": H2SO4 + 2 NaOH = Na2SO4 + 2 H2O H3PO4 + 3 NaOH = Na3PO4 + 3 H2O Рассмотрим важнейшие химические свойства кислот.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот. Об индикаторах мы более подробно расскажем в следующем параграфе на примере их реакций с основаниями. 2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH: H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
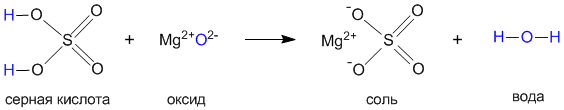
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации. Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл. 8-3). Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами. Табл. 8-3. Ряд активности металлов.
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части табл. 8-3. Под силой кислоты понимают ее способность отдавать ионы водорода H+. Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать). С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части табл. 8-3. В связи с этим существует еще одна классификация кислот – по силе. В таблице 8-4 в каждой из колонок сила кислот уменьшается сверху вниз. Таблица 8-4. Классификация кислот на сильные и слабые кислоты.
** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например: Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O 3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O 8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O 3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е.безводными) кислотами – серной кислотой и азотной кислотой.
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках. Задачи. 8.10. Напишите реакции нейтрализации между кислотами и основаниями, в результате которых получаются следующие соли: Al2(SO4)3, NiCO3, Fe(NO3)3, Mg3(PO4)2, PbS, Li2SO4. 8.11. Сколько P2O5 необходимо для получения 392 кг фосфорной кислоты H3PO4 ? ** 8.12 (ФМШ). При растворении в H2SO4 10,48 г смеси оксидов CuO и ZnO образовалось 20,88 г смеси безводных сульфатов CuSO4 и ZnSO4. Определите состав взятой смеси. ** 8.13. Напишите формулы водородных соединений пяти элементов главной подгруппы VI группы. Все они в той или иной мере являются кислотами. Исходя из закономерностей Периодической таблицы, расположите эти кислоты в ряд от самой слабой до самой сильной кислоты.Соли. Получение и химические свойства. Рассмотрим важнейшие способы получения солей. 1. Реакция нейтрализации. Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно!) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
3. Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
СаСО3 + Н2СО3 = Са(НСО3)2 (раствор) 4. Реакция основных и кислотных оксидов между собой:
6. Реакция оснований с солями. Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой: NaCl + KBr = Na+ + Cl- + K+ + Br- Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается. 8. Реакция металлов с кислотами. В способах 1 – 7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
Теперь рассмотрим химические свойства солей. Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций. 1. Окислительно-восстановительные реакции солей. Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления. а) Реакции за счет иона металла. Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее , являются более активными. Нетрудно заметить, что это те же реакции металлов с солями (см. пункт 10 предыдущего раздела). б) Реакции за счет кислотного остатка. В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
2. Обменные реакции солей. Такие реакции могут происходить в растворах, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. Например: а) CuSO4 + H2S = CuS↓ (осадок) + H2SO4 AgNO3 + HCl = AgCl↓ (осадок) + HNO3 б) FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4 в) BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl Некоторые из этих реакций уже встречались в опытах из первой части параграфа. Во всех случаях один из продуктов обменной реакции обязательно должен покидать реакционную смесь в виде осадка или газообразного вещества. Либо должно получаться прочное соединение, не распадающееся в растворе на ионы (например, вода в реакции нейтрализации). Если эти условия не выполняется, то при смешивании реагентов в лучшем случае образуется смесь не реагирующих между собой ионов - реакция не идет. Задачи 8.27 (ФМШ). Продолжите уравнения реакций и уравняйте их. Если есть продукты, выпадающие в осадок или выделяющиеся в виде газа, поставьте после них стрелку вниз или вверх. 1) AgNO3 + FeCl3 = 2) Pb(NO3)2 + K2S = 3) Ba(NO3)2 + Al2(SO4)3 = 4) CaCl2 + Na3PO4 = 5) Na2S + HCl = 6) (NH4)2SO4 + KOH = 7) K2CO3 + H2SO4 = 8) Ba(HCO3)2 + H2SO4 = 9) Al2O3 + KOH (избыток) = 10) SiO2 + NaOH = 11) NaHCO3 + HCl = 12) NaHCO3 + NaOH = 13) [Cu(OH)]2SO4 + KOH = 14) [Cu(OH)]2SO4 + H2SO4 = 15) MgO + HBr = 16) MgO + SO3 = 17) K2S + HNO3 = кислая соль + ... 18) Mg(OH)2 + H2SO4 = основная соль + ... 19) FeSO4 + KMnO4 + ... = MnSO4 + ... 20) K2SO3 + K2Cr2O7 + H2SO4 =

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.