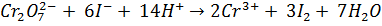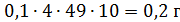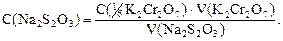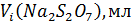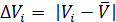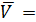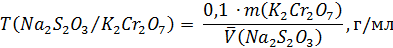|
|
Теоретические основы методаКристаллическому тиосульфату натрия соответствует формула Na2S2O3∙5H2O. Однако состав даже чистого препарата тиосульфата натрия этой формуле практически не соответствует, поэтому сначала готовят приблизительно 0,1 моль/л раствор, а затем проводят его стандартизацию по рабочему раствору йода или дихромата калия K2Cr2O7. Дихроматометрическое определение – один из методов окислительно-восстановительного титрования, основанный на использовании бихромата калия K2Cr207 в качестве окислителя. При действии на восстановители бихромат-ион Cr2O72- приобретает шесть электронов и восстанавливается до Cr3+: Cr2O72 + 6 ē +14 Н+ = 2 Cr3+ +7 Н2О Индикатором при бихроматометрическом титровании является дифениламин, окрашивающий раствор в синий цвет при небольшом избытке бихромата. Стандартизацию раствора тиосульфата натрия проводят методом заместительного титрования. В основе определения лежат следующие реакции:
При проведении расчетов следует учитывать, что эквивалент вещества соответствует числу электронов, участвующих в реакции окисления-восстановления. Опыт 1. Приготовление стандартного раствора бихромата калия с молярной концентрацией эквивалента C(l/6 K2Cr207) 0,1 моль/л, объемом 250 мл. Стандартный раствор готовят растворением точной навески бихромата калия (х.ч.) в мерной колбе. Бихромат калия должен быть предварительно перекристаллизован и высушен при 1500С. Рассчитайте массу навески дихромата калия, нужной для приготовления 100,0 мл раствора с С(1/6 К2Сr2О7) = 0,1000 моль/л. М(1/6 К2Сr2О7) = 49,03 г/моль. Навеску бихромата калия рассчитывают с учетом объема мерной колбы, пипетки, бюретки и концентрации приготовленного раствора тиосульфата натрия. Учитывая, что на титрование аликвоты раствора бихромата калия должно пойти 4 мл 0,1М тиосульфата натрия и соотношение мерной колбы и пипетки 100/10, рассчитываем массу бихромата калия:
Точная навеска бихромата калия лежит в пределах 0,18‒0,22 г. Пробирку с бихроматом калия взвешивают на аналитических весах, отсыпают бихромат через воронку в мерную колбу на 100 мл и взвешивают пробирку с бихроматом калия. Дистиллированной водой смывают дихромат калия с воронки в колбу, взбалтывают содержимое колбы до полного растворения бихромата калия и только после этого доливают воду до метки. Раствор хорошо перемешивают. Ход работы 1. Взвесьте на аналитических весах в сухом чистом стаканчике рассчитанное количество дихромата калия. Масса стаканчика – Масса стаканчика с К2Сr2О7 – Масса навески – 2. Растворите навеску в небольшом объеме воды и количественно перенесите в мерную колбу на 100 мл, добавьте небольшое количество воды, хорошо перемешайте, доведите водой до метки. 3. Рассчитайте молярную концентрацию эквивалента К2Сr2О7 в полученном растворе, титриметрический фактор пересчета по Na2S2O3.
Опыт 2.Стандартизация раствора тиосульфата натрия по дихромату калия. Стандартизация тиосульфата натрия по дихромату калия основана на восстановлении дихромат-ионов избытком КI по реакции:
Сr2О72– + 9 I– + 14 H3O+ → 2 Cr3+ + 3 I3– + 21 H2O,
E0(Сr2О72–, 14 H3O+/2 Cr3+) = 1,33 B.
Выделившийся иод оттитровывают раствором Na2S2O3 (заместительное титрование):
I3– + 2 S2O32– → 3 I– + S4O62–.
Для окисления иодида калия необходимо присутствие кислоты, при недостатке которой реакция идет медленно. Несмотря на высокую кислотность, тиосульфат при титровании иода не разлагается кислотой, скорость его реакции с иодом значительно больше. Тем не менее, желательно медленное добавление титранта и хорошее перемешивание, т.к. при быстром приливании больших порций тиосульфата в отдельных частях раствора может создаваться местный избыток его, когда еще не весь иод оттитрован; в отсутствие последнего тиосульфат разлагается кислотой. При восстановлении дихромат-ионов образуются Сr3+-ионы, затрудняющие своей окраской фиксирование точки эквивалентности. Чтобы ослабить окраску, раствор перед титрованием сильно разбавляют водой. Закон эквивалентов для случая заместительного титрования имеет вид: n(1/z X) = n(1/z B) = n(1/z T),
C(1/z X)∙V(X) = C(1/z T)∙V(T).
В случае стандартизации раствора тиосульфата натрия: C(Na2S2O3)∙V(Na2S2O3) = C(1/6 К2Сr2О7)∙V(К2Сr2О7)
и Рабочий раствор тиосульфата натрия готовят по навеске, исходя из заданной концентрации раствора и его объема. Например, для приготовления 200 мл 0,1М раствора тиосульфата натрия отвешивают в бюксе на технических весах 5 г тиосульфата натрия (0,1∙0,2∙248 = 5г). Взятую навеску растворяют в 200 мл дистиллированной воды и добавляют 0,02 г карбоната натрия. Раствор хранят в склянке из темного стекла. Определение точной концентрации раствора тиосульфата натрия проводится по 2-3 точным навескам бихромата калия полумикрометодом (бюретка объемом 5 мл, цена деления 0,01 мл). Ход работы 1. Заполните бюретку раствором тиосульфата натрия. 2. Пипетку на 10 мл промойте раствором бихромата калия и отберите 1/10 часть в коническую колбу для титрования объемом 100-150 мл, добавьте 5мл 10% раствора KI и 5 мл 2М раствора HCl. 3. Колбу закройте часовым стеклом и поставьте на 3-5 минут в темное место. 4. Снимите часовое стекло и ополосните его над колбой дистиллированной водой. Прибавьте в колбу еще около 30 мл воды и оттитруйте выделившийся йод тиосульфатом натрия до светло-желтой окраски раствора в колбе. Титрование производите по каплям, хорошо перемешивая раствор. 5. Добавьте в колбу 2-3 мл (50 капель) раствора крахмала. Раствор в колбе станет синим. 6. Медленно продолжайте титровать до перехода синей окраски раствора в бледно-зеленую (почти бесцветную) от одной капли раствора тиосульфата натрия. Сделайте несколько определений до получения сходящихся результатов. При втором и последующих титрованиях крахмал добавляется ближе к концу титрования. Отсчет объема раствора тиосульфата натрия ведется с точностью до ±0,005 мл. Результаты титрования занести в таблицу.
По экспериментальным данным рассчитывают титр тиосульфата натрия по бихромату калия:
7. Рассчитайте молярную концентрацию тиосульфата натрия в приготовленном растворе и титр тиосульфата натрия по меди:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
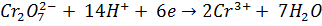 | 1
| 1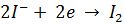 | 3
| 3