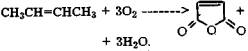|
|
ВЫБОР ОПТИМАЛЬНОГО МЕТОДА ПОЛУЧЕНИЯ N-МЕТИЛПИРРОЛИДОНАА.В. де Векки, В.А. Головачев N-Метилпирролидон является экстрагентом и используется при производстве ароматических углеводородов, для очистки природного и технологических газов от сероводорода и других сернистых соединений, в процессах выделения и селективной очистки газов пиролиза и смазочных масел. Последнее направление является наиболее важным и во многом определяет масштабы развития производства данного продукта за рубежом. Известно, что по своим экстракционным свойствам, растворяющей способности и селективности метилпирролидон превосходит фенол и фурфурол - традиционные растворители, используемые в настоящее время в отечественной промышленности при производстве смазочных масел. К тому же фенол токсичен (ПДК 0,3 мг/м3), а фурфурол остродефицитен, так как получается из пентозансодержащего сырья. В то же время N-метилпирролидон относится к 4-ому классу опасности (ПДК 100 мг/м3), характеризуется хорошей термической стабильностью, коррозионно неагрессивен и может регенерироваться доступными методами. По имеющимся данным, замена фенола или фурфурола на действующих установках селективной очистки масел на метилпирролидон позволяет на 30% снизить энергозатраты, на 20-25% увеличить пропускную способность установки, в 2-3 раза уменьшить потери растворителя. На сегодня в мире действует более 20 промышленных установок очистки масляных дистиллятов с применением метилпирролидона, подтвердивших несомненную перспективность использования данного растворителя и необходимость дальнейшего перевода всех установок на значительно более ценный экстрагент. Однако потребность в метилпирролидоне только в странах бывшего СССР достигает 20 тыс.т/год, в то время как 90% производств базируются на морально устаревшем методе Реппе. Дальнейшее расширение этого метода стало невозможным из-за взрывоопасности процесса, высокой стоимости ацетилена, больших текущих затрат, неэкологичности процесса и достижения предела изобретательской активности ведущих фирм в области усовершенствования ключевой стадии - получении 1,4-бутандиола. Кроме того, по мнению специалистов фирмы BASF, данный способ экономичен при мощности по 1,4-бутандиолу не менее 30 тыс.т/год. С учетом перечисленных фактов выбор оптимального метода синтеза N-метилпирролидона и последующая его разработка является актуальной задачей. Авторами рассматриваются более подробно наиболее известные методы получения N-метилпирролидона, начиная с уже упомянутого выше синтеза по Реппе, базирующегося на карбидном ацетилене: СаС2 + Н2O —> CHºCH + Ca(OН)2 На катализаторе медь-висмут на силикагеле при 100-120 °С и давлении 0,55 МПа ацетилен карбинолируется в 1,4-бутиндиол с выходом 90-95%: СНºСН + 2СН2 —> HOCH2CºCCH2OH В дальнейшем бутиндиол гидрируют в 1,4-бутандиол на медно-никель-хромовом катализаторе при 100 °С и давлении 27-28 МПа (выход продукта 90-95%): HOCH2CºCCH2OH + 2Н2 ——>НОСН2СН2СН2СН2ОH На следующей стадии 1,4-бутандиол дегидроциклизуют в у-бутиролактон с выходом 96-98% при 250-270 °С и давлении 0,06 МПа на катализаторе НТК-4:
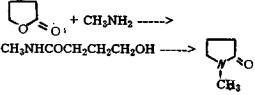
Заключительной стадией является термическая конденсация бутиролактона с монометиламином, которая протекает при 240-270 °С, давлении 4,5-6,0 МПа двухступенчато через метиламид 4-оксимасляной кислоты, которую в свою очередь получают при 80-150 и давлении 5 МПа.
Выход целевого продукта 96-98%. Первоначально этот метод был внедрен на "Фарбениндустри", а затем использован фирмами BASF (ФРГ) и Du Pont (США) [1, 2]. В 1970 г. он был реализован на Новочеркасском заводе синтетических продуктов. Последнее время попытки модернизировать процесс преимущественно касались всех его стадий. Так, на стадии синтеза бутиндиола пытались применить суспендированные соединения меди, по-видимому, ацетилиды, а на стадии синтеза бутандиола - суспендированвый никель Ренея [3, 4]. Этот прием позволил снизить давление на второй и третьей стадиях процесса соответственно до 0,14 и 1,5-2,0 МПа. Однако использование суспендированных контактов по Ренею больше свойственно препаративной химии, a от применения ацетилидов тяжелых металлов из-за их крайне взрывоопасных свойств давно отказались в промышленном органическом синтезе. Усовершенствование четвертой стадии процесса (синтез у-бутиролактона) практически закончено, а используемый круг катализаторов ограничивается в основном медьсодержащими контактами [5-11], за небольшим исключением [12, 13]. Анализ литературных данных позволяет констатировать, что практически все альтернативные методы синтеза относятся именно к получению у-бутиролактона - фатально неизбежному сырью для получения метилпирролидона. Сам бутиролактон можно получать различными методами, которые рассматриваются более подробно.
Фирмой Daicel (Япония) разработан, но не внедрен способ получения бутандиола ацетоксилированием пропилена до аллилацетата на палладиевом катализаторе (преимущественно нитрате палладия [14]) при 65 °С и 0,5 МПа (конверсия 72%, селективность 74%) [15]. Аллилацетат гидроформилируют, а образовавшийся ацетоксибутаналь подвергают последовательно гидрированию и гидролизу, при этом конечным продуктом является 1,4-бутандиол. Бутандиол превращают в N-метилпирролидон по указанной выше схеме. Недостатками этой схемы являются: невысокий выход 1,4-бутандиола в расчете на пропилен (60%), необходимость больших капиталовложений, сравнительно высокая себестоимость диола, большие количества сточных вод и газовых выбросов. Данный метод может быть экономичен в том случае, если пропилен селективно окислять непосредственно в аллиловый спирт, чем в настоящее время занимаются японские фирмы Showa Denko и Kura-ray [16]. В 1982 г. японской фирмой Mitsubishi Chem. Ind. разработан и внедрен процесс получения 1,4-бутандиола мощностью до 18 тыс.т/год ацетоксилированием 1,3-бутадиена на теллуриде палладия при 70 °С и давлении воздуха 7 МПа [17]. Процесс протекает в три стадии: ацётоксилирование, гидрирование 1,4-диацетокси-2-бутена и гидролиз 1,4-диацетоксибутана: СН2=СНСН=СН2 + 2АсОН + 0,5О2 ——> АсОСН2СН=СНСН2ОАс + Н2О АсОСН2СН=СНСН2ОАс + Н2 ——> АсО(СН2)4ОАс АсО(СН2)4ОАс + 2Н2О ——> НО(СН2)4ОН + 2АсОН Гидрирование 1,4-диацетокси-2-бутена протекает при 80 °С, давлении водорода 6 МПа с селективностью 97,6% и 100%-ной конверсией на катализаторах, представляющих собой никелевые композиции на диатомовой земле [18]. Гидролитическую стадию осуществляют в двух реакторах на катионообменных смолах, температура до 100 °С, давление 0,1-1 МПа. Выход 1,4-бутандиола и совместно (или целенаправленно) получающегося тетрагидрофурана близок к количественному [18]. По мнению японских специалистов, данный метод получения 1,4-бутандиола является самым экономичным [19]. Другой метод получения 1,4-бутандиола заключается в неполном хлорировании 1,3-бутадиена, последующем гидролизе 1,4-дихлорбутена в 1,4-бутендиол и гидрировании последнего в конечный продукт:
Этот процесс разработан японской фирмой Toyo Soda, и производство начало функционировать в 1971 г. на установке мощностью 6 тыс.т/год [20]. Данный способ имеет ряд преимуществ по сравнению с методом Регате, так как в качестве сырья применяют побочный продукт производства хлоропреновых каучуков, упрощена схема гидрирования, низкие капитальные затраты. К недостаткам относятся экологические проблемы, в частности, со сточными водами и высокая коррозионная агрессивность среды. Одним из перспективных способов получения N-метилпирролидона является метод, базирующийся на использовании в качестве сырья бутан-бутиленовой фракции, получаемой в значительных количествах на установках каталитического крекинга, и основан на окислении указанной фракции в малеиновый ангидрид:
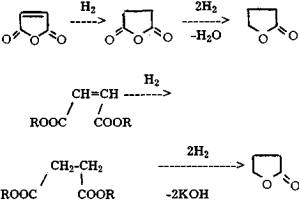
Реакция протекает при 370-410 °С, давлении 0,12-0,30 МПа с использованием фосфорванадиевого катализатора. Выход малеинового ангидрида не превышает 50%. Цепочка дальнейших превращений малеинового ангидрида выглядит следующим образом: гидрируют малеиновый ангидрид или сложные эфиры малеиновой кислоты в у-бутиролактон, который затем, как обычно, конденсируют с монометиламином.
Впервые процесс гидрирования малеинового ангидрида в бутиролактон и тетрагидрофуран был вьшолнен и реализован в промышленности японской фирмой Mitsubishi Yuka в 1971 г. мощностью 5 тыс.т/год [21]. По имеющимся сведениям, жидкофазное гидрирование ангидрида осуществляют при давлениях водорода до 60 МПа в широком температурном интервале над катализаторами на основе никеля и кобальта [22]. При использовании никелевых катализаторов, модифицированных молибденом, вольфрамом, железом или медью, процесс протекает при давлении 30-50 МПа [28]. Используются катализаторы и на основе палладия [24,25], однако минимальное давление не ниже 10 МПа, а суммарная селективность по у-бутиролактону и тетрагидрофурану составляет 96-98%. Японской фирмой Daynippon Incorp. разработан парофазный процесс совместного получения лактона, ТГФ и 1,4-бутандиола [26]. Паровая фаза позволила использовать более мягкие катализаторы гидрирования на основе меди, цинка с добавками бериллия, никеля, кобальта, молибдена, вольфрама, хрома, палладия, платины и свинца [27-29]. Процесс протекает при 100-325 °С и давлении до 1 МПа. Недавно появились сведения о создании катализатора, работающего при атмосферном давлении и температуре 210-230 °С. Катализатор представляет собой нанесенные определенным образом на силикагель окислы никеля, церия, циркония и позволяет количественно конвертировать сырье при 85-87%-ной селективности по целевому продукту [30]. Несмотря на большое число разработок по гидрированию малеинового ангидрида и достижению в отдельных случаях высоких показателей по конверсии и селективности, главный недостаток этих процессов - высокая коррозионная активность - не устранен. Коррозионно-агрессивными являются как исходное сырье, так и продукты деструкции - низкомолекулярные карбоновые кислоты, что приводит к быстрой потере активности катализаторами и выводу из строя оборудования. Для устранения перечисленных недостатков малеиновый ангидрид переводят в диалкиловые эфиры соответствующей кислоты, которые получают взаимодействием ангидрида с одноосновными спиртами C1-C4 (см., например, [31]):
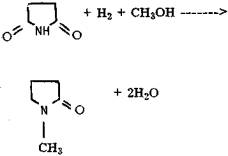
В качестве катализаторов для периодического варианта проведения данной реакции используют бензол- или толуолсульфокислоты. При непрерывном способе производства применяют катионообменные смолы, содержащие сульфо-группу и имеющие макропористую структуру [32-34]. Реакцию проводят при 110-120 °С при избытке бутанола 1:2,2-20 (моли) по отношению к ангидриду. Часто применяют в качестве антренеров гептан, бензол, толуол и т.п. [33]. Получение у-бутиролактона из диалкилмалеината протекает в результате гидроциклизации, минуя стадию образования 1,4-бутандиола, например, на хромите меди, содержащем барий, под давлением водорода до 1,2 МПа и температуре 180-260 °С (выход лактона 85%) [35]. Также возможно использовать катализаторы, содержащие никель или кобальт, осажденные на фторированную окись алюминия [36]. Процесс осуществляют при 200-350 °С и давлении выше 10 МПа (выход лактона 70%). Использование медь-цинк-хромовых катализаторов позволяет достигать конверсии сырья около 100% и селективности 77% при проведении реакции при 260-280 °С и атмосферном давлении [37]. Как указывалось выше, заключительной стадией процесса является конденсация у-бутиролактона с монометиламином, которая на действующем в Новочеркасске производстве протекает в некаталитическом режиме в жидкой фазе при 240-265 °С и давлении 4,5-6 МПа. Промышленные зарубежные методы также ориентируются на жидкую фазу и чисто термический режим, Выход N-метилпирролидона достигает 85-87%. Однако предложено проводить стадию конденсации в присутствии щелочного агента и воды [38,39], а также различных катализаторов [40,41]. Применение цеолитов X, У, А, где X и У могут быть заменены на редкоземельные металлы и водород, позволяет при атмосферном давлении и 200-500 °С достигать выход пирролидона 88% [40]. Сообщается также [41], что в цеолитах У обменные катионы могут быть замещены на Н, щелочные, щелочноземельные металлы, медь, никель, кобальт и цинк. На примере пропилпирролидона показано, что при 280 °С на СаУ достигается равновесный выход пирролидона со 100%-ной селективностью. Другие работы посвящены получению N-метилпирролидона из янтарной кислоты и сукцинимида и представляют на сегодня познавательный интерес из-за отсутствия сырьевой базы. Один из таких методов заключается во взаимодействии янтарной кислоты с метиламином при 227-241 °С с одновременной отгонкой воды, при этом N-метилсукцинимид образуется с выходом 60%. Гидрирование проводят при 200 °С и давлении 20-25 МПа в среде безводного диоксана (выход целевого продукта 72%), катализатор - 6-8%-ный никель Ренея [37].
Одностадийный способ получения N-метилпирролидона предлагают французские исследователи [42]. Суть метода состоит в прямом взаимодействии янтарной кислоты с монометиламином при 200-300 °С и давлении водорода 5-20 МПа в присутствии скелетных катализаторов на основе кобальта, никеля, родия или палладия. В качестве растворителя применяют воду, диоксан или тетрагидрофуран (выход целевого продукта 80,5%). В свою очередь русскими исследователями предложено гидрировать сукцинимид в спиртовой среде при 200-280 °С и давлении водорода 20-30 МПа на катализаторе кобальт или никель на оксиде алюминия [43]:
Выход целевого продукта 73-77%. Анализ накопленного опыта работы по синтезу N-метилпирролидона свидетельствует о том, что на сегодня самым экономичным способом, его получения является путь через ацетоксилирование 1,3-бутадиена, который, к сожалению, составляет только 5% от всего объема производства 1,4-бутандиола. С другой стороны, к наиболее обеспеченным сырьевой базой следует отнести метод гидрирования алкиловых эфиров малеиновой кислоты. СПИСОК ЛИТЕРАТУРЫ 1. Реппе. // Химия ацетилена, - М.: ИЛ, 1954. - С. 284. 2. Anon. // Chem. Eng. - 1951. - V. 58. - № 6. - С. 176-179. 3. Отчет НИР: Разработка технологического процесса получения 1,4-бутандиола - сырья для производства усовершенствованных защитных материалов. - М.: ГосНИИМетанолпро-ект, 1987. - С. 1 4. ТЭО: Организация производства N-метилпирролидона на основе ацетилена, выделяемого из этан-этиленовой фракции установок ЭП-300. - М.: ВНИИОС, 1988. - 69 с 5. Oka Shinzaburo// Bull Chem. Soc. Japan.-1961. -V. 34. - № 1. - P. 12-14. 6. Пат. 106533 ЧССР, 1963. 7. Иванский В.И., Долгов Б.Н. // Кинетика и катализ. - 1963. - Т. 4. - № 1. - С. 165-166. 8. Пат. 50062 ГДР, 1966. 9. Пат. 1066979 Англии, 1967. 10. а.с. 193487 СССР, 1967. 11. Якушкин М.И., Девекки А.В., Перелетова О.И. и др. // Нефтехимия. - 1989. - Т. 29. - № 6. -С. 792-797. 12. а.с. 468918 СССР, 1975. 13. Заявка 58-13574 Японии, 1983. 14. Адельсон С.В., Вишнякова Т.П., Паушкин Я.М. Технология нефтехимического синтеза. - М.: Химия, 1985. - С. 208, 409 15. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. - М.: Химия, 1981. -С. 453. 16. Japan Chem. Week. - 1986. - V. 27. - № 1354. - P. 3. 17. Мельникова Л.М. // Химическая пром. за рубежом. - 1984. - № 9. - С. 57 18. Brownstein A.M., List H.L. // Hydrocarbon Process. - 1977. - V. 56. - P. 159. 19. Тanabe Y. // Hydrocarbon Process. - 1981. - V. 60. -№ 9. - P. 187. 20. Chem. Econ. and Eng. Review. - 1980. - V. 12. - № 9. -P. 32. 21. Chem. Eng. News. - 1968. - № 40. - P. 63-64. 22. Локтев С.М., Дышлис В.Д., Кацобашвили В.Я. // Нефтепереработка и нефтехимия: НТРС. - М.: ЦНИИТЭнефтехим, 1978. - № 2. - С. 34-35. 23. Пат. 30271 Японии, 1973. 24. Заявка 62-111974 Японии, 1987. 25. Заявка 62-111975 Японии, 1987. 26. Информационный материал фирмы Sumitomo Shaji Kaisha Ltd. о процессе производства N-метилпирролидона из малеинового ангидрида, 1975. 27. Пат. 23294 Японии, 1972. 28. Пат. 4001282 США, 1977. 29. Пат. 4105674 США, 1978. 30. Пат. 4668654 США, 1988. 31. Dharwadker A., Hussain S.Z. // Indian J. TechnoL - 1977. - V. 15. - P. 156. 32. Николаев А.Ф., Галуткина К.А., Саливон Н.Я. // Хим. промышленность. - 1967. - № 10. 33. Пат. 229117 ГДР, 1985. 34. А.с. 1245568 СССР, 1986. 35. Заявка 3539151 ФРГ, 1986. 36. А.с. 242872 СССР, 1969. 37. А.с. 143806 СССР, 1962. 38. Пат. 21420 Японии, 1972. 39. Пат. 146054 ЧССР, 1972. 40. Пат. 3775431 США, 1973. 41. К о Ch., Loschpo О. // Bull. Chem. Soc. Japan. 1977. - V. 50. - № 10. - P. 2517. 42. Пат. 1439192 Франции, 1967. 43. A.c., 259889 СССР, 1962.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|