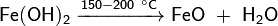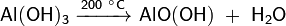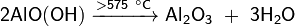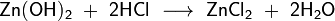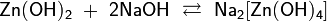|
|
Физ. И хим. Свойства кислот12 Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды. Например, если раскалённое железный прутик, да и не толко железный (можно взять цинк Zn, олово Sn, сивнец Pb, медь Cu, - вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами.
Физические свойства Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого.
Химические:
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов: 2. Взаимодействие с кислотами с образованием соли и воды 3. Взаимодействие с кислотными оксидами с образованием соли 4. Взаимодействие с амфотерными оксидами
3. Характеристика пероксидов и надпероксидов. Пероксиды (ранее назывались перекиси) – вещества, содержащие пероксогруппу –О–О– (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксиды легко выделяюткислород. Надпероксиды -хим. неорганическое кислородное соединение, содержащее анион О2−, т.е содержащее атомы О в степени окисления −½
4. Химические/физические свойства оснований Большинство оснований – твёрдые вещества с различной растворимостью в воде.
Химические: 1). Изменяют окраску индикаторов 2) Взаимодействие с кислотными оксидами
-реакция обмена 2KOH + CO2 = K2CO3 + H2O Ca(OH)2 + CO2 = CaCO3 + H2O 3) Взаимодействие с кислотами
-реакция обмена (нейтрализация) Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O Тренажёр "Реакция нейтрализации" Видео "Реакция нейтрализации" 4) С растворами солей, если в результате образуется осадок
-реакция обмена FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ 1) С кислотами - реакция обмена
2) Разлагаются при нагревании
-реакция разложения Cu(OH)2 = CuO + H2O или 2Fe(OH)3 = Fe2O3 +3H2O
5. Амфотерные гидроксиды. Получение. Хим. свойства Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вныхгидроксидов. Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.). Химические свойства таких гидратов по большей части аналогичны свойствам соответствующих гидроксидов. При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
6. Кислоты. Классификация. Особенности номенклатуры
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств. § По содержанию кислорода § бескислородные (HCl, H2S); § кислородосодержащие (HNO3,H2SO4). § По основности — количество кислых атомов водорода § Одноосновные (HNO3); § Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты); § Трёхосновные (H3PO4, H3BO3). § Полиосновные (практически не встречаются). § По силе § Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3); § Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5). § По устойчивости § Устойчивые (H2SO4); § Неустойчивые (H2CO3). § По принадлежности к классам химических соединений § Неорганические (HBr); § Органические (HCOOH,CH3COOH); § По летучести § Летучие (H2S, HCl); § Нелетучие (H2SO4) ; § По растворимости в воде § Растворимые (H2SO4); § Нерастворимые (H2SiO3);
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные итривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой. Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая). Для разных кислородсодержащих кислот, образованных одним элементом, используется -истая для более низкой степени окисления (сернистая, азотистая). В ряде случаев для промежуточных степеней окисления дополнительно используются морфемы -новатая и -новатистая (см. ниже названия кислородсодержащих кислот хлора). Для менее известных кислот, содержащих кислотообразующие элементы в переменных степенях окисления, обычно применяются систематические названия. В систематических названиях кислот к корню латинского названия кислотообразующего элемента добавляют суффикс -ат, а названия остальных элементов или их групп в анионе приобретают соединительную гласную -о. В скобках указывают степень окисления кислотообразующего элемента, если она имеет целочисленное значение. В противном случае в название включают и число атомов водород
Физ. И хим. Свойства кислот Физические свойства. Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|