
|
|
Определение активности ферментов.Регуляция активности ферментов путем белково-белковых взаимодействий. Возможны два механизма регуляции активности ферментов таким путем. 1. Регуляция в результате присоединения регуляторных белков. Можно рассмотреть на примере фермента аденилатциклазы, локализованного в плазматической мембране клетки. Этот фермент катализирует реакцию образования цАМФ из АТФ. Активный центр фермента расположен с цитоплазматической стороны мембраны, а сигналом, для начала синтеза является присоединение гормона (адреналина, глюкагона) к рецепторному белку на наружной внеклеточной стороне мембраны. Промежуточным звеном в передаче гормонального сигнала служит G-белок (ГТФ-связывающий белок). После присоединения гормона к рецептору G-белок меняет свою конформацию, связывает ГТФ, диссоциирует на две части и один из протомеров связывается с аденилатциклазой, активируя её. В этой системе G-белок выполняет регуляторную функцию.
2. Регуляция активности ферментов путем ассоциации/диссоциации субъединиц. Можно рассмотреть на примере фермента протеинкиназы. Этот фермент катализирует реакцию переноса остатка фосфорной кислоты с АТФ на ОН-группы белков-ферментов. Молекула протеинкиназы состоит из 4-х протомеров (субъединиц) 2-х типов: 2 – регуляторных (R) и 2- каталитических (C). Каталитические субъединицы содержат активные центры, а регуляторные – по два центра связывания цАМФ. После присоединения к молекуле протеинкиназы 4-х молекул цАМФ, конформация фермента меняется и он диссоциирует на регуляторный димер и две активные каталитические субъединицы.
Отсоединение цАМФ от регуляторных субъединиц приводит к ассоциации комплекса с потерей его активности. Регуляция ферментативной активности путем ковалентной модификации. Два механизма. Фосфорилирование/дефосфорилирование. Это быстрый и широкораспространенный способ регуляции активности ферментов. Фосфорилированию подвергаются ОН-группы аминокислотных остатков ферментов. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование – фосфатазами. Присоединение фосфорной кислоты к молекуле фермента приводит к изменению конформации активного центра и изменению его активности. При этом, в зависимости от фермента, активность может возрастать, а может – уменьшаться. Дефосфорилирование вызывает противоположный эффект.
Активность протеинкиназ и фосфатаз контролируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических процессов в зависимости от условий в организме. Например, в период между приемами пищи в клетках печени под действием глюкагона запускается процесс фосфорилирования ряда ферментов, ответственных за запасание и использование резервных энергетических субстратов – гликогена и триацилглицеролов. При этом ферменты, участвующие в распаде (мобилизации) этих соединений – гликогенфосфорилаза и липаза переходят в активное состояние, а ферменты, участвующие в синтезе – гликогенсинтаза - в неактивное. Во время пищеварения, под действием инсулина, наоборот, активируются процессы синтеза гликогена и резервных жиров и тормозится их распад, т.к. инсулин запускает процесс дефосфорилирования тех же ферментов. Т.О. в клетке, в данный момент времени может идти или только процесс синтеза гликогена или его мобилизация. 2. Частичный протеолиз. Некоторые ферменты, функционирующие вне клеток (в желудочно-кишечном тракте или в плазме крови), синтезируются в виде неактивных предшественников – проферментов или зимогенов. Их активация происходит путем разрыва одной или нескольких пептидных связей и отщепления части белковой молекулы. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента. Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина. Его предшественник – трипсиноген, синтезируется в поджелудочной железе и поступает при пищеварении по протокам поджелудочной железы в двенадцатиперстную кишку. В просвете кишки трипсиноген подвергается частичному протеолизу под действием фермента кишечного сока – энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части пептида. Образовавшиеся молекулы трипсина, обладают аутокаталитической активностью (т.е. способны вызывать частичный протеолиз трипсиногена) и запускают в кишечнике каскад активации всех протеолитических проферментов поступающих туда из поджелудочной железы (химотрипсиноген, проэлластаза, проколлагеназа).
В желудке путем частичного протеолиза под действием соляной кислоты и аутокаталитически происходит активация пепсиногена с образованием пепсина. В плазме крови частичный протеолиз запускает каскад активации ферментов свертывания крови, (например, протромбин – тромбин, фибриноген – фибрин) приводящий к образованию сгустка. Значение существования проферментов: · Защита клетки, в которой вырабатывается фермент от его разрушающего действия · Возможность накопления ферментов · Возможность быстрой активации в нужный момент
Структурно-функциональная организация ферментов. Изоферменты. Ферменты, катализирующие одну и туже химическую реакцию, но отличающиеся по первичной структуре белка называют изоферментами или изоэнзимами. Другими словами, изоферменты это множественные формы одного фермента. Катализируя одну и ту же реакцию, изоферменты отличаются физико-химическими свойствами (молекулярной массой, электрофоретической подвижностью), кинетическими характеристиками (сродством к субстрату), особенностями активации. Рассмотрим особенности функционирования изоферментов на примере лактатдегидрогеназы (ЛДГ). ЛДГ катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты), коферментом служит молекула НАД. СООН СООН
СН3 СН3 Лактат пируват
ЛДГ – олигомерный белок (имеет четвертичную структуру), состоящий из 4-х субъединиц 2-х типов: М (от англ. muscle) и Н (от англ. heart). Комбинация этих субъединиц лежит в основе формирования 5 изоформ ЛДГ.
ЛДГ и ЛДГ наиболее активны в сердечной мышце, ЛДГ и ЛДГ в скелетных мышцах и печени. В основе существования изоферментов лежат структурные различия кодирующих их генов. Появление в эволюции различных форм ЛДГ обусловлено особенностями окислительного метаболизма тканей. М-типы ЛДГ работают эффективно в анаэробных условиях, Н- типы – в аэробных, когда образующийся пируват далее быстро окисляется до углекислого газа и воды. Тканевая специфичность изоформ ЛДГ позволяет использовать определение их активности в крови для диагностики ряда заболеваний. Общая активность ЛДГ крови повышается при острых поражениях сердца, печени, почек, мышц, что связано с разрушением клеток этих органов и тканей и выходом ферментов в кровь. Для уточнения диагноза необходимо определить какая из изоформ преобладает в крови. Это возможно определить методом электрофореза, так как Н-формы обладают большим отрицательным зарядом и соответсвенно большей подвижностью в электрическом поле. Увеличение в крови количества ЛДГ и ЛДГ свидетельствует об инфаркте миокарда. Кроме ЛДГ несколькими изоферментными формами представлены такие ферменты как креатинкиназа, гексокиназа, пируваткиназа и др. Мультиферменты. Мультифермент или мультиэнзим это структурно-функциональный комплекс из нескольких ферментов, катализирующих последовательное превращение одного субстрата. Рассмотрим строение мультифермента на примере пируватдегидрогеназного комплекса. Эта мультиферментная система локализована в митохондриях клеток и катализирует необратимую реакцию окислительного декарбоксилирования пирувата. Суммарное уравнение реакции:
СН3 СН3 ½ Е1; Е2;; Е3 ½
½ . ½ СООН S-КоА Пируват Ацетил-КоА
В объединенном процессе дегидрирования и декарбоксилирования пирувата участвуют 3 фермента: Е-1 Пируватдегидрогеназа Е-2 Дигидролипоил-ацетилтрансфераза (трансацилаза) Е-3 Дигидролипоилдегидрогеназа И 5 коферментов : ТДФ (сод. Вит В , липоевая кислота, HS-КоА (пантотеновая кислота), НАД (РР), ФАД (В ). В центре комплекса находится «ядро» образованное 24 субъединицами трансацилазы, в каждой из которых в активном центре находятся два остатка липоевой кислоты, ковалентно присоединенные к остаткам лизина. Вокруг ядра располагаются крупные субъединицы пируватдегидрогеназы с прочно связанным коферментом ТДФ и дигидролипоилдегидрогеназы с коферментом ФАД. Липоевая кислота в составе центрального фермента выполняет функцию поворотного кронштейна, переносящего промежуточные продукты с фермента на фермент и функционально объединяющего их. В состав комплекса входят также молекулы диссоциирующих непрочно связанных коферментов НАД и HS-КоА, выполняющих функции акцепторов конечных продуктов реакции – отщепляемых атомов водорода и ацетила - остатка уксусной кислоты. Особенность функционирования мультифермента заключается в том, что промежуточные продукты реакции не попадают в окружающую фермент среду. Объединение набора ферментов, катализирующих многоступенчатую последовательность реакций в макромолекулярный комплекс позволяет: – четко координировать работу ферментов – задавать направление потока промежуточных метаболитов – ускорять метаболический процесс – эффективно регулировать процесс за счет межферментных взаимодействий. Регуляторным ферментом комплекса, катализирующим лимитирующую стадию процесса является Е-1 пируватдегидрогеназа. Активность этого фермента регулируется по двум механизмам. 1. Аллостерическая регуляция. Ингибиторами комплекса являются НАДН и ацетил-КоА – конечные продукты реакции. 2. Ковалентная модификация. В присутствии АТФ активность комплекса резко снижается. Это связано с тем, что АТФ активирует фермент киназу, который использует АТФ для фосфорилирования остатка серина в активном центре пируватдегидрогеназы, в результате чего образуется неактивная форма фермента. При снижении уровня АТФ активируется другой фермент – фосфатаза, который отщепляет от пируватдегидрогеназы фосфат и восстанавливает активность фермента. И киназа и фосфатаза также входят в состав мультиферментного комплекса, который представляет собой саморегулирующуюся систему. Если упростить вопрос регуляции активности мультиферментного комплекса пируватдегидрогеназа, то можно сказать что его активность регулируется двумя соотношениями: АТФ/АДФ и НАДН/НАД. Увеличение этих соотношений приводит к подавлению активности комплекса, а уменьшение – к активации. Применение ферментов в медицине. Ферментные препараты широко используются в медицине по двум основным направлениям – в энзимодиагностике и энзимотерапии. Энзимодиагностика – постановка диагнозана основе определения активности ферментов в биологических жидкостях человека. При многих заболеваниях происходит повреждение клеток и их содержимое, в том числе ферменты, высвобождаются в кровь или из-за нарушения проницаемости мембран клеток (при воспалительных процессах) или за счет нарушения целостности клеток (при некрозе). Уровень активности ферментов в крови коррелирует со степенью повреждения клеток. Примерами ферментов, определение активности которых в крови используется для диагностики состояния разных органов является ЛДГ, АСТ, АЛТ, КФК и др. Энзимотерапия – использование ферментов в качестве лекарственных препаратов: – заместительная терапия при заболеваниях связанных с недостаточностью секретирования пищеварительных соков (фестал, энзистал, мезим) – комплексная терапия – использование ферментов в качестве дополнительных терапевтических средств. Протеолитические ферменты (трипсин, химотрипсин) применяют при лечении гнойных ран, при тромбозах используют препараты фибринолизина, урокиназы. Фермент гиалуронидазу (лидазу) используют для рассасывания рубцов после ожогов и операций. При использовании ферментов в медицине следует упомянуть такую форму их применения, как иммобилизованные ферменты. Это ферменты ковалентно закрепленные на полимерной основе. Такие ферменты имеют ряд преимуществ: – дополнительные ковалентные связи делают их более устойчивыми к действию повреждающих факторов (температуры, протеолитических ферментов) – можно обеспечить высокую локальную концентрацию в зоне применения – за счет подбора носителя можно добиться избирательности действия. Например, упоминавшийся уже фермент урокиназа, используемый для лечении тромбозов, фиксируется на фибриногене, который обеспечивает высокое сродство препарата к формирующимся сгусткам. Определение активности ферментов. Измерение ферментативной активности основывается на сравнении скорости химической реакции в присутствии активного биокатализатора со скоростью реакции в контрольном растворе, в котором фермент отсутствует или инактивирован. Для того чтобы определить скорость ферментативной реакции, необходимо знать: 1) разность концентраций субстрата или продукта реакции до и после инкубации; 2) время инкубации; 3) количество материала, взятое для анализа и его разведение. Активность фермента рассчитывается по формуле: а – активность фермента (общая); DС – разность концентраций субстрата до и после инкубации; В – количество материала, взятого на анализ; t - время инкубации; n - разведение. За единицу общей активности фермента принимают такое количество фермента, которое катализирует превращение 1 мкмоль (10 –6 моль) субстрата в единицу времени (1 мин, 1 час) в расчёте на количество материала, взятого для исследования. За единицу удельной активности принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на 1 мг белка пробы. Удельную активность определяют в том случае, когда нужно сопоставить активность разных препаратов одного и того же фермента. Если требуется сравнить активность разных ферментов, рассчитывают молекулярную активность. Молекулярная активность (или число оборотов фермента) – это количество моль субстрата, подвергающееся превращению под действием 1 моль фермента в единицу времени (обычно в 1 минуту).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|



 НС–ОН + НАД+ С=О + НАДН+Н+
НС–ОН + НАД+ С=О + НАДН+Н+
 С=О + НАД+ + КоА-SН С=О + СО2 + НАДН+Н+
С=О + НАД+ + КоА-SН С=О + СО2 + НАДН+Н+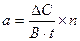 , где
, где