
|
|
Введение энтропии Р. КлаузиусомЛекция 11. Энтропия и её роль в науке. Математическая формулировка второго закона термодинамики Переходя к математическому выражению второго закона термодинамики, Клаузиус сначала обосновывает, что связь теплоты
Здесь Затем Клаузиус показывает, что
Таким образом,
или
С учетом того, что
После этого для обратимых циклов Клаузиус обосновывает соотношение
«Это уравнение, — пишет Клаузиус, — которое я впервые опубликовал в 1854 г., дает весьма удобное выражение второго начала механической теории теплоты, поскольку оно относится к обратимым круговым процессам. Смысл его может быть выражен словесно следующим образом: если в некотором обратимом круговом процессе мы разделим каждый поглощаемый изменяющимся телом (положительный или отрицательный) элемент количества теплоты на абсолютную температуру поглощения и полученное таким образом дифференциальное выражение проинтегрируем для всего кругового процесса, то значение интеграла будет равняться нулю».
Введение энтропии Р. Клаузиусом Равенство (5.5), впервые выведенное Клаузиусом, имеет в теории термодинамики огромное значение. На основании этого равенства Клаузиус ввел понятие энтропии. Он писал: «Если интеграл
относится к любым последовательным изменениям тела, становится равным нулю каждый раз, когда тело вновь возвращается в свое начальное состояние, то стоящее под знаком интеграла выражение
или
Это уравнение дает еще одно выражение второго начала механической теории теплоты, очень удобное во многих исследованиях». Величину S Клаузиус назвал энтропией ( от греч entropia — превращение). Далее, анализируя замкнутый цикл необратимого процесса, Клаузиус показал, что для этого случая интеграл вдоль кривой цикла функции
Необратимый процесс не может быть изображен некоторой кривой в какой-либо системе координат. Однако условно необратимые процессы изображают (часто пунктирными) линиями, параметры которых являются осредненными по объему системы (тела). Так как энтропия S cистемы является функцией ее состояния, то при возвращении системы в исходное состояние ее энтропия должна принять прежнее (начальное) значение, а при приращении энтропии системы
Для выполнения этого условия с учетом неравенства (5.8) необходимо, чтобы полное изменение энтропии системы определялось бы следующим образом:
Здесь
Второе слагаемое в (5.9) Таким образом, для замкнутого необратимого процесса (цикла) справедливое равенство
Аналогично и в случае произвольного необратимого незамкнутого процесса 1-2 изменение энтропии предоставляется в виде
Элементарное изменение энтропии в необратимом процессе равно
Из последнего равенства следует, что второй закон термодинамики определяет направление реальных процессов. Так, например, адиабатные необратимые процессы (для этих процессов
Любые другие процессы могут проходить только так, чтобы приращение энтропии за счет необратимости было больше нуля, т. е.
Для замкнутой адиабатной системы тел (теплоизолированной системы) всегда выполняется условие
поэтому энтропия такой системы может только возрастать:
Далее Клаузиус показал, что работоспособность энергии при необратимых процессах понижается. Это следует из того, что все необратимые процессы неравновесны и осуществляются при наличии конечных разностей давлений, температур, концентраций и т. п. В результате самопроизвольных необратимых процессов указанные разности стремятся к нулю и система приходит в состояние равновесия, при котором любые самопроизвольные энергетические процессы становятся невозможными. Более того, наличие трения и других явлений приводит к тому, что все виды энергии частично или полностью переходят в тепловую энергию. Но тепловая энергия, как правило, является наименее ценной энергией. Напомним, что тепловая энергия является энергией неупорядоченного движения частиц, нетепловая энергия — энергия упорядоченного движения частиц Согласно второму закону термодинамики в условиях Земли тепловая энергия не может полностью превращаться тепловой машиной в другой вид энергии. Наоборот, все другие виды энергии могут почти полностью превращаться друг в друга и полностью переходить в тепловую энергию. Кроме того, после превращения части тепловой энергии в другие виды энергии оставшаяся часть тепловой энергии, которая отводится во внешнюю среду, оказывается как бы «испорченной», так как эта часть энергии уже будет иметь температуру окружающей среды (значительно меньшую исходной). Таким образом, одного лишь учета сохранения количества энергии недостаточно для того, чтобы судить о возможности осуществления того или иного энергетического процесса. Энергию следует характеризовать не только количеством, но и качеством. Второй закон термодинамики утверждает, что энергия данного качества сама собой может превращаться только в энергию равного или более низкого качества. Величиной, определяющей качество энергии системы, является энтропия. Возрастание энтропии, сопровождающееся выравниванием указанных выше параметров, в изолированной системе приводит к установлению равновесия в системе. В этот момент энтропия системы достигает максимума, и дальнейшие самопроизвольные процессы становятся невозможными. Это свойство энтропии изолированной системы можно рассматривать как одну из формулировок второго закона термодинамики: энтропия всякой изолированной системы стремится к максимуму. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 и
и  в обратимом прямом цикле Карно выражается соотношением
в обратимом прямом цикле Карно выражается соотношением
 . Напомним, что обратимым процессом называется равновесный процесс, который тело может проходить как в прямом, так и в обратном направлениях. При этом в обратном направлении тело проходит те же состояния, что и в прямом, только в обратной последовательности. В результате такого прямого и обратного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.
. Напомним, что обратимым процессом называется равновесный процесс, который тело может проходить как в прямом, так и в обратном направлениях. При этом в обратном направлении тело проходит те же состояния, что и в прямом, только в обратной последовательности. В результате такого прямого и обратного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.


 , последнее равенство примет вид
, последнее равенство примет вид
 (5.5)
(5.5)
 должно быть полным дифференциалом некоторой величины, которая зависит только от данного состояния тела, а не от пути, которым тело в это состояние пришло. Если мы обозначим эту величину через
должно быть полным дифференциалом некоторой величины, которая зависит только от данного состояния тела, а не от пути, которым тело в это состояние пришло. Если мы обозначим эту величину через  , то сможем положить
, то сможем положить (5.6)
(5.6) (5.7)
(5.7) всегда меньше нуля, т. е.
всегда меньше нуля, т. е. (5.8.)
(5.8.) в процессе цикла должно быть равным нулю, т. е.
в процессе цикла должно быть равным нулю, т. е.
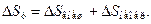 (5.9)
(5.9) означает изменение энтропии системы, происходящее в результате теплообмена с внешними телами за цикл, т. е.
означает изменение энтропии системы, происходящее в результате теплообмена с внешними телами за цикл, т. е. (5.10)
(5.10) по определению положительная величина
по определению положительная величина  . При наличии необратимости величина
. При наличии необратимости величина  ( 5.11)
( 5.11)
 (5.12)
(5.12) ) могут проходить только в направлении роста энтропии, так как в этих случаях
) могут проходить только в направлении роста энтропии, так как в этих случаях


