
|
|
Электрический ток в электролитахЛекция 11
Ток в газах
Любые газы в нормальном состоянии, в том числе и пары металлов, состоят из электрически нейтральных атомов и молекул и поэтому не проводят электрический ток. Проводниками электрического тока могут быть ионизированные газы, которые содержат электроны, положительные и отрицательные ионы. Ионизация газа происходит под действием высоких температур, рентгеновских и ультрафиолетовых лучей, g - лучей, космических лучей и т. д. При этом происходит удаление одного или нескольких электронов из атома или молекулы. Такой процесс называют ионизацией. Возникшие электроны могут присоединиться к нейтральным атомам или молекулам, превращая их в отрицательно заряженные ионы. После прекращения действия ионизатора положительные и отрицательные ионы газа могут соединиться между собой с образованием нейтральных атомов или молекул. Такой процесс называют рекомбинацией. В установившемся режиме наступает динамическое равновесие между ионизацией и рекомбинацией. Ток в газах можно наблюдать в газонаполненной трубке с двумя электродами. Если к электродам приложить напряжение, то в газе возникает электрический ток. При одинаковой концентрации носителей по всему объему трубки плотность тока в газах описывается формулой j = no(m++m-)E, (1) где m+ и m- - подвижности положительных и отрицательных носителей тока соответственно; Е - напряженность электрического поля; no - концентрация носителей. При движении носителей тока в среде во внешнем электрическом поле на них действуют две силы: кулоновская сила со стороны поля Fk = qE и сила сопротивления со стороны среды
Следовательно, закон движения, согласно классической теории проводимости, запишется виде Если режим стационарный, т. е. где дрейфовая скорость носителей
или m = где - подвижность носителя тока; m - масса носителя; t - время релаксации носителей, определяемое как среднее время, когда их движение теряет свою упорядоченность. В СИ подвижность измеряется в м2/(B×c). При упорядоченном движении положительных и отрицательных носителей возникает электрический ток, плотность которого j = q+n+vд++ q-n-vд- , (5) или удельная электропроводность s = q+n+m+ + q-n-m-. (6)
Если носители тока в газах образуются в трубке за счет внешнего ионизатора, то такая проводимость (газовый разряд) называется несамостоятельным газовым разрядом. В относительно слабых электрических полях для тока в газах выполняется закон Ома. В более сильных электрических полях закон Ома уже не выполняется. На рис. 1 приведена вольт-амперная характеристика газоразрядной трубки с двумя электродами. Участок ВС соответствует току насыщения. Возрастание тока на участке СD связано с появлением внутренних источников ионов. Если напряжение между анодом и катодом велико, то ионы приобретают большую кинетическую энергию и способны выбивать при столкновении с катодом вторичные электроны (ударная ионизация). Электроны больших энергий при столкновениях с молекулами газа ионизируют их, также порождая вторичные электроны и ионы, которые, в свою очередь, ускоряются электрическим полем. Если удалить внешний ионизатор, то несамостоятельный разряд переходит в самостоятельный, основным источником которого является ударная ионизация. Различают несколько видов самостоятельного газового разряда (при нормальных и больших давлениях). 1. Коронный разряд - возникает в неоднородном электрическом поле, 2. При повышении напряжения коронный разряд переходит в кистевой и искровой, в виде молнии. 3. Дуговой разряд возникает за счет термоэлектронной эмиссии при малом напряжении между электродами и большом токе.
Электрический ток в жидкостях
Электрический ток в электролитах
Электролитами называются вещества, в которых электрический ток осуществляется за счет движения положительных и отрицательных ионов (ионная проводимость). Ионная проводимость - упорядоченное движение положительных и отрицательных ионов под действием внешнего электрического поля. Электролитами являются растворы кислот и щелочей, солей, а также солевых расплавов. Ионами называются атомы или молекулы, потерявшие или присоединившие к себе один или несколько электронов. Положительные ионы называют катионами, отрицательные ионы -анионами. Электрическое поле, вызывающее упорядоченное движение положительных и отрицательных ионов, создается в жидкостях электродами - проводниками (медь, алюминий и др.). Положительно заряженный электрод называют анодом, отрицательно заряженный электрод - катодом. Положительно заряженными ионами (катионы) являются ионы металлов и водородные ионы. В электрическом поле они движутся к катоду. Отрицательно заряженными ионами (анионы) - кислотные остатки и гидроксильные группы ОН - движутся к аноду. Прохождение электрического тока через жидкость сопровождается электролизом - выделением на электродах веществ, входящих в состав электролита. Электролиты иногда называют проводниками II рода. В них ток связан с переносом вещества в отличие от металлических проводников (металлы и их сплавы) - проводников I рода, в которых носителями электрического тока являются коллективизированные электроны (отрицательно заряженные частицы). Возникновение ионов в электролитах происходит за счет электролитической диссоциации - распада молекул растворенного вещества на положительные и отрицательные ионы в результате взаимодействия с растворителем. Молекулы растворенных веществ состоят из взаимосвязанных ионов противоположного знака (полярных молекул). Например, Na+Cl-, H+Cl-, Cu++SO4-- и т. д. Силы кулоновского притяжения между этими ионами обеспечивают целостность таких молекул. Взаимодействие молекул с полярными молекулами растворителя, например, воды (H2O), приводит к ослаблению взаимного кулоновского притяжения противоположно заряженных ионов. В результате теплового хаотического движения молекул (броуновское движение) растворенных веществ и растворителей происходит их столкновения, которые вызывают распад молекул (диссоциация) на положительно и отрицательно заряженные ионы. Диссоциация молекул характеризуется степенью диссоциации a - отношением числа молекул N0, диссоциаировавщих на ионы противоположного знака, к общему числу молекул N вещества:
Степень диссоциации зависит от температуры (Т), концентрации раствора (С) и диэлектрической проницаемости (e) растворителя. Процесс броуновского теплового хаотического движения ионов в растворе приводит к воссоединению ионов противоположного знака с образованием нейтральных молекул. Этот процесс называют рекомбинацией (молизацией) ионов. Между процессами электрической диссоциации и рекомбинацией ионов при неизменных условиях устанавливается динамическое равновесие, при котором число молекул, распадающихся на ионы в единицу времени, равно числу пар ионов, которое за это же время рекомбинирующих в нейтральные молекулы. В состоянии динамического равновесия раствор электролита характеризуется определенной степенью диссоциации a, определяет число носителей тока в жидкостях, т. е. ионов противоположного знака. Ионы в электролитах движутся хаотически до тех пор, пока в жидкости отсутствует электрическое поле. При создании внешнего электрического поля в электролитических ваннах на тепловое хаотическое движение положительно и отрицательно заряженные ионы накладывается их упорядоченное движение к соответствующим электродам и в жидкости возникает электрический ток. Плотность электрического тока j в электролитах подчиняется закону Ома, т. е. j = gЕ = Е/r.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. .
.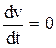 (а = 0), то
(а = 0), то  ,
, , (2)
, (2) , (3)
, (3) , (4)
, (4) Рис. 1
Рис. 1
 (7)
(7)