
|
|
Механизм возникновения электродного и редокс потенциалаТема 12. Окислительно-восстановительные реакции. Редокс-равновесия и процессы. Коррозия химическая и электрохимическая. Окислительно-восстановительная реакция - это реакция, при которой происходит изменение степени окисления веществ. Степень окисления - это условный заряд атома, рассчитанный из предположения, если бы все связи в соединении были бы ионными. Степень окисления может быть положительной, отрицательной, равной нулю или дробным значением. Постоянная степень окисления: у металлов 1-ой группы (+1) литий, натрий, калий и т.д., второй группы (+2) магний, кальций, барий и т.д., в третьей группе – алюминий (+3); Фтор – наиболее электроотрицательный элемент и степень окисления всегда -1 Валентность – это число связей элемента в химическом соединении. Может быть только положительным, целым числом. Окисление– это процесс отдачи электронов, элемент, отдающий электроны называется восстановителем. Восстановление– это процесс присоединения электронов, элемент, присоединяющий электроны называется окислителем. Для расчета фактора эквивалентности окислителя/восстановителя используют следующую формулу feq = 1/n, где n - число электронов присоединенных или отданных в результате реакции. Важнейшие окислители 1) Элементы V, VI, VII групп F2, Cl2, O2... 2) Молекулы и ионы, содержащие металлы или неметаллы в высшей степени окисления BiO32-, MnO4-, Cr2O72-, PbO2,NO3-, HClO4, (NH4)2S2O8 Важнейшие восстановители 1) Элементы главных групп I и II, щелочные и щелочноземельные металлы Mg, K, Cs, Rb. 2) Ионы металлов и неметаллов в низшей степени окисления Sn2+, Fe2+, Cr3+, Mn2+,Br-, I-, S2-, O2-, N3- Частицы с промежуточной степенью окисления проявляют двойственный характер. Cl-, Cl2, Cl+, Cl+3, Cl+5, Cl+7 только двойственные св-ва только окислитель восстановитель Основные типы О-В реакций: 1) межмолекулярные - окислитель и восстановитель находятся в разных молекулах; 2) внутримолекулярные - окислитель и восстановитель находятся в одной молекуле; 3) диспропорционирования - когда окислителем и восстановителем является одно и то же вещество; из одной степени окисления получаются разные; В санитарно-гигиенической практике и медицине используют следующие окислители: 1) 3% водный раствор перекиси водорода Н2О2, водный раствор перманганата калия КМnО4, спиртовой раствор йода - антисептики; 2) для обеззараживания питьевой воды используют хлорирование и озонирование. 3) гипохлорит кальция Ca(ClО)2 используют для дезинфекции туалетов и т.д. Механизм возникновения электродного и редокс потенциала
Me - 2e à Me 2+ Граничный слой раствора в этом случае заряжается положительно, а сам металл - отрицательно. Величина скачка напряжения называется электродным потенциалом.Величина электродного потенциала может быть измерена только относительно другого электрода (например, стандартного водородного электрода).
Потенциал зависит от температуры раствора, природы вещества, концентрации металла или (для окислительно-восстановительных реакций) концентрации окисленной и восстановленной формы. Для расчета потенциала в реальных условиях используют уравнение Нернста
На величину электродного потенциала не влияют концентрации твердых веществ и чистого растворителя (воды), но если в полуреакциях участвуют ионы H+ и OH‑, то потенциал зависит от их активностей. Например, для полуреакции Гальванический элемент
Гальванический элемент – это устройство для преобразования химической энергии в электрическую. Схема записи гальванического элемента следующая: анод | анодный раствор || катодный раствор | катод Например, для данного элемента: Zn|ZnSO4||CuSO4|Cu ЭДС – электродвижущая сила – определяет максимальную работу, которую можно получить из гальванического элемента: Направление протекания окислительно-восстановительной реакции: реакция проходит в прямом направлении, если ЭДС > 0 и в обратном, если ЭДС < 0 Общее правило: окислительно-восстановительная реакция протекает от более сильного окислителя к более слабому – от окислителя пары с большим значением потенциала к окислителю пары с меньшим значением потенциала В живых системах протекают процессы, которые в общем виде можно представить следующим уравнением:Н-субстрат-Н + ½ О2 →Н2О + дегидрированный (окисленный) субстрат Организм превращает в полезную работу около 40% энергии, выделяющейся при окислении субстратов. Достигается это постепенным переносом протонов и электронов от субстрата к молекулярному кислороду. Увеличение промежуточных стадий способствует приближению реального процесса к равновесному. Электронотранспортная цепь локализована во внутренней мембране митохондрий. Каждый компонент клеточной дыхательной цепи - участник окислительно-восстановительного процесса - характеризуется определенным значением окислительно-восстановительного потенциала. Движение электронов в клеточной дыхательной цепи происходит ступенчато от веществ с низким потенциалом (-0.324 В) к веществам с более высоким потенциалом (+0.82 В). Таким образом, транспорт электрона от субстрата к молекуле кислорода осуществляется благодаря повторяющимся (осциллирующим) редокс – реакциям. При функционировании данной системы осуществляется выброс протонов из внутренней мембраны в межмембранное пространство - это процесс эндергонический, т.е. требующий затраты энергии, и он возможен за счет экзергонических редокс - реакций. Образование воды на конечной стадии окисления требует переноса на молекулу кислорода не только электронов, но и протонов: 4Н+ + 4е + О2 →2Н2О Обратный перенос протонов в цитоплазму через специальные протонные каналы является экзергоническим процессом и высвобождаемая при этом энергия расходуется на синтез АТФ из АМФ и фосфата. На каждую пару электронов, переданных по клеточной дыхательной цепи, синтезируются три молекулы АТФ. Потоки протонов и электронов в митохондриях разобщены, за счет чего сопрягаются два важнейших процесса: окисление субстратов и образование АТФ (фосфорилирование). Рассмотренная совокупность процессов получила название окислительного фосфорилирования. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 При помещении металла в раствор его соли для активных металлов (например, цинк) происходит очень малое, но растворение металла
При помещении металла в раствор его соли для активных металлов (например, цинк) происходит очень малое, но растворение металла Стандартный водородный электрод (СВЭ) представляет собой платиновую пластинку, покрытую платиновой чернью, с площадью активной поверхности 1 м2, опущенную в раствор H2SO4 с активностью H+ 1 моль/л и через который пропускается газообразный водород при давлении 1 атм. Потенциал такого электрода при Т = 298 К принят равным нулю.
Стандартный водородный электрод (СВЭ) представляет собой платиновую пластинку, покрытую платиновой чернью, с площадью активной поверхности 1 м2, опущенную в раствор H2SO4 с активностью H+ 1 моль/л и через который пропускается газообразный водород при давлении 1 атм. Потенциал такого электрода при Т = 298 К принят равным нулю. После подстановки: R = 8.314; T = 298 K; F = 96500 и переходу к десятичному логарифму получают:
После подстановки: R = 8.314; T = 298 K; F = 96500 и переходу к десятичному логарифму получают: В данном уравнении n – количество электронов переходящих в процессе реакции.
В данном уравнении n – количество электронов переходящих в процессе реакции. - Стандартным электродным потенциалом называется потенциал, возникающий на поверхности металла, опущенного в раствор его соли с концентрацией 1 моль/л при Т = 298 К и измеренный относительно стандартного водородного электрода.
- Стандартным электродным потенциалом называется потенциал, возникающий на поверхности металла, опущенного в раствор его соли с концентрацией 1 моль/л при Т = 298 К и измеренный относительно стандартного водородного электрода.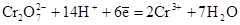 при 298 К уравнение Нернста будет выглядеть следующим образом:
при 298 К уравнение Нернста будет выглядеть следующим образом:  .
. Если два различных металла погрузить в раствор их солей, то между ними возникнет разность потенциалов. Это простейшийгальванический элемент.
Если два различных металла погрузить в раствор их солей, то между ними возникнет разность потенциалов. Это простейшийгальванический элемент.