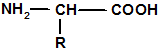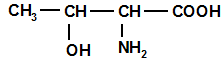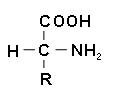|
|
Общие свойства протеиногенных аминокислотЛекция 1 ВВЕДЕНИЕ В ДИСЦИПЛИНУ. ХИМИЯ АМИНОКИСЛОТ
1. Введение в дисциплину. Принципы классификации природных соединений. Общая характеристика, свойства и биологическая роль аминокислот. Классификация протеиногенных аминокислот. Химические свойства аминокислот. 1. Введение в дисциплину Химия БАВ –раздел органической химии, который изучает строение, свойства и биологические функции химических соединений, входящих в состав живых организмов.
Химия БАВ изучает биополимеры и биорегуляторы. Биополимеры – высокомолекулярные природные соединения, которые являются структурной основой всех живых организмов и играют определенную роль в процессах жизнедеятельности (белки, полисахариды, нуклеиновые кислоты, липиды). Биорегуляторы – соединения, которые химически регулируют обмен веществ (витамины, гормоны, многие синтетические БАВ). Принципы классификации природных соединений 1. По химическому строению. Так, большинство природных соединений содержат 2 и более функциональных групп и имеют различия в строении углеродного скелета. Поэтому их одновременно можно отнести к нескольким классам. Принадлежность к определённому классу определяют, если необходимо подчеркнуть характерные функции в организме.
2. Биохимическая классификация (по отношению к метаболизму): - Первичные метаболиты – молекулы, которые присутствуют во всех клетках организма и необходимы для жизнедеятельности (белки, углеводы, липиды, нуклеиновые кислоты); - Вторичные метаболиты – низкомолекулярные органические молекулы; встречаются не во всех клетках и не у всех видов живых организмов (алкалоиды, изопреноиды, фенольные и минорные соединения, витамины, антибиотики). Они являются БАВ и синтезируются из первичных метаболитов. 3. По биологической активности: - Биологически важные – их физиологическая роль чётко выражена и достаточно хорошо изучена; обычно биологически инертны. - Биологически активные – они даже в очень малых количествах вызывают физиологическую или патологическую реакцию (гормоны, антибиотики, токсины, фитоалексины, мутагены, канцерогены и т.д.).
4. По природным источникам. Различают продукты животного происхождения, растительного и выделяемые из микроорганизмов, вторичные метаболиты морских организмов.
Общая характеристика, свойства и биологическая роль аминокислот
Аминокислоты – гетерофункциональные органические соединения, молекулы которых содержат одновременно аминные и карбоксильные группы.
Общая формула аминокислот
В организме млекопитающих найдено около 70 аминокислот, причем 20 из них входят в состав всех белков (протеиногенные аминокислоты). Также имеется ряд минорных аминокислот (химическая модификация основных протеиногенных аминокислот) – гидроксипролин, гидроксилизин, они являются компонентами лишь некоторых белков.
Общие свойства протеиногенных аминокислот
1. Являются производными карбоновых кислот:
Глицин NН2 ― СН2 ― СООН
СН3 ― СООН – уксусная Лизин
СН2 ― СН2 ― СН2 ― СН2 ― СН2 ― СООН – капроновая 2 Являются α-аминокислотами:
Треонин 3. Если в аминокислоте две аминогруппы, то вторая присоединена к последнему атому углерода цепи, начиная от карбоксильной группы:
Глутамин 4. Все аминокислоты (кроме глицина) имеют ассиметрический атом углерода, т.е. такой атом, который связан с четырьмя различными атомами или группами атомов:
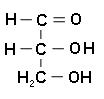
Аланин 5. Для всех α-аминокислот (кроме глицина) характерна оптическая активность. Природные и содержащиеся в организме аминокислоты – это L-стереоизомеры, имеют такое же взаимное расположение заместителей, как у L-глицеринового альдегида:
L-глицериновый альдегид D-глицериновый альдегид
L-аминокислота D-аминокислота
D-стереомеры не входят в состав белков, они встречаются в составе коротких пептидов, продуцируемых микроорганизмами, встречаются в составе биополимеров клеточной стенки бактерий. Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
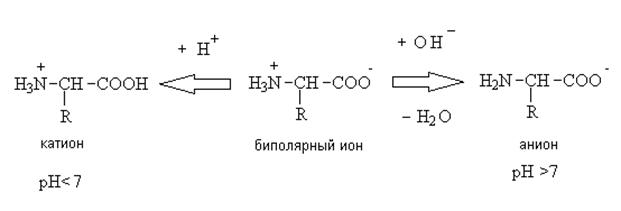
6. В растворах и кристаллическом виде аминокислоты являются амфолитами:
В кристаллическом состоянии они существуют в виде внутренних солей, которые образуются в результате внутримолекулярного переноса протона от более слабого кислотного центра (СОО-) к более сильному основному центру (NH2).
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой. В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3+). Биологическая роль аминокислот: - участие в построении и обновлении белков организма; - участие в образовании фармакологически и физиологически активных веществ; - взаимопревращение аминокислот в углеводы и жиры. Каждая аминокислота имеет определенное биологическое значение: - глицин – его много в белках сухожилий; - серин – его много в белках, которые образуют стенки полостей (например, мочевого пузыря); - цистеин – входит в состав большинства ферментов, гормонов, белков; - аргинин – необходим для синтеза мочевины; - при недостатке валина на коже появляются плохо заживающие язвочки; - аспарагиновая и глутаминовая кислоты участвуют в процессах детоксикации аммиака; - тирозин необходим для построения гормонов щитовидной железы и надпочечников; - при недостатке триптофана ослабляется усвоение витаминов. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|