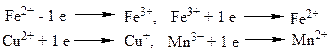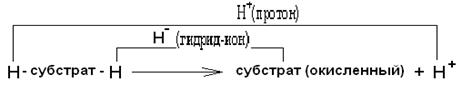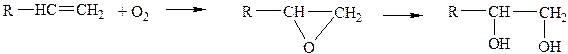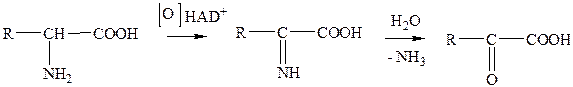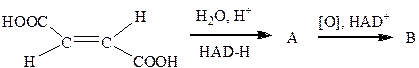|
|
Б) Перенос атома водорода (свободно - радикальные реакции окисления).Модульная единица 1.1. «Номенклатура органических соединений. Природные сопряженные структуры. Кислотно-основные взаимодействия в механизме реализации свойств важнейших классов биоорганических соединений. Окислительно-восстановительные процессы в организме» Занятие 1.1.6. Методические указания для студентов ТЕМА: «Окисление и восстановление биоорганических соединений» ЦЕЛЬ: Изучить способы и механизмы осуществления окислительно-восстановительных реакций органических веществ в организме человека. ЗНАТЬ: Процессы окисления и восстановления в органической химии. Способы передачи электронов в реакциях окисления-восстановления биоорганических соединений. Окисление непредельных соединений на примере реакций эпоксидирования, гидроксилирования. Реакции окисления-восстановления в парах органических кислот (янтарная кислота -фумаровая к-та; яблочная кислота - щавелевоуксусная кислота; молочная – пировиноградная; изолимонная - 2-оксо-3-карбксиглутаровая кислота). Реакции обратимого окисления тиолов, окисление аминов. УМЕТЬ: Определять способ передачи электронов в реакциях окисления-восстановления биоорганических соединений. Приводить реакции эпоксидирования, гидроксилирования, окисления-восстановления тиолов, аминов, органических кислот. ВЛАДЕТЬ: Навыками написания основных реакций окисления и восстановления биоорганических соединений. ЗНАЧЕНИЕ ИЗУЧЕНИЯ ТЕМЫ: Реакции окисления и восстановления имеют большое значение в качестве ключевых процессов, определяющих метаболизм (катаболизм) пищевых веществ в организме человека. Реакции окислительного гидроксилирования лежат в основе детоксикации ксенобиотиков, в том числе лекарственных веществ. I. Теоретические вопросы 1. Определение реакций окисления и восстановления. Какие соединения являются окислителем, восстановителем. Окислительно-восстановительные пары. Конкретные способы передачи электронов в реакциях окисления-восстановления. 1.1. Одноэлектронный перенос в окислительно-восстановительной паре металлов переменной валентности (Fe2+ - Fe3+, Fe3+ - Fe2+, Cu2+ - Cu+, Mn3+ - Mn2+). 1.2. Перенос атома водорода (свободнорадикальные реакции окисления, сопровождающиеся гомолитическим разрывом связей) 1.3. Перенос электронов от донора к акцептору в виде гидридиона Н-. 2. Прямое взаимодействие с кислородом с образованием ковалентных связей с атомом кислорода - на примере реакций эпоксидирования, гидроксилирования (Окисление непредельных соединений). 3. Реакции окисления-восстановления, обратимо протекающие в парах органических кислот (чаще их ионов): сукцинат (янтарная кислота) - фумарат (фумаровая к-та); малат (соль яблочной кислоты) - оксалоацетат (щавелевоуксусная кислота); лактат (молочная) - пируват (пировиноградная), изоцитрат (изолимонная)- оксалосукцинат (2-оксо-3-карбксиглутаровая кислота). Реакции имеют место в цикле Кребса (сопряжены с синтезом АТФ). 4. Реакции обратимого окисления – восстановления тиолов, образование дисульфидов (на примере окисления цистеина в цистин, дигидролипоевой кислоты в липоевую). 5. Окисление аминов. Окислительное дезаминирование, реакции восстановления нитросоединений до аминов. II. Обучающие упражнения Задание 1. Способы переноса электронов в окислительно-восстановительных реакциях в биоорганической химии. Вариант ответа: а) В организме человека одноэлектронный перенос осуществляется в активном центре ферментов (каталазы, гемоглобина, цитохромов, супероксиддисмутаз) в окислительно-восстановительных парах:
При этом восстановитель отдает электроны, окислитель - принимает их. б) Перенос атома водорода (свободно - радикальные реакции окисления). Свободно-радикальные процессы окисления,сопровождающиеся переносом водорода, имеют важное значение как реакции неферментативного окисления липидов. Неконтролируемый процесс свободно-радикального окисления липидов ведет к возникновению ряда патологических заболеваний. в) Перенос электронов от донора к акцептору в виде гидрид-иона Н-. В результате реакции окисления происходит перенос гидрид-иона от субстрата согласно схеме:
г) Прямое взаимодействие с кислородом с образованием ковалентных связей с атомом кислорода - на примере реакций эпоксидирования, гидроксилирования
эпоксид гликоль
Задание 2. Показать реакции окислительного дезаминирования аминокислот в общем виде. Вариант ответа:
III. Задания для самостоятельной работы Задание 1. Напишите продукты и механизм гидроксилирования фенилаланина. Какое значение имеют реакции гидроксилирования в организме человека? Задание 2.Написать продукты в следующей цепочке превращений, назвать их.
(щавелевоуксусная кислота) Задание4. Напишите формулу 2-оксобутандиовой (щавелевоуксусной) кислоты, которая является одним из продуктов углеводного обмена. Напишите схему реакции восстановления кислоты и назовите продукт восстановления.
IV. Выполнение самостоятельной аудиторной работы«Окисление и восстановление биоорганических соединений»

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|