
|
|
Электронное строение атомов химических элементов и структура периодической таблицыЭлектронное строение атомов химических элементов и структура периодической таблицы.
Химические свойства атомов элементов, в основном, связаны с электронами внешних орбиталей. Электрон — это частица, обладающая элементарным отрицательным зарядом. Его поведение характеризуется набором из четырех квантовых чисел:главного квантового числа “n”, орбитального квантового числа “l” , магнитного квантового числа “ml” и спинового квантового числа “ms”. Главное квантовое число “n” характеризует радиус орбитали и ее энергию. Орбитальное квантовое число “l” характеризует форму электронных орбиталей и в меньшей степени энергию . Магнитное квантовое число“ml” определяет ориентацию орбиталей под действием внешнего магнитного поля и количество орбиталей того или иного типа» Спиновое квантовое число “ms” определяет вращение электрона вокруг собственной оси. Главное квантовое число может принимать значения n =1...¥, орбитальное квантовое число может принимать значения l =0,1,2,3... n -1. Магнитное квантовое число может принимать значения ml = - l, 0, l Наконец, спиновое квантовое число принимает значения ms=±1/2 Распределение электронов по орбиталям подчиняется трем правилам; правилу наименьших энергий (Клечковского), принципу запрета Паули и правилу Хунда. В соответствии с принципом наименьших энергий электроны занимают в первую очередь орбитали с минимальной энергией. По возрастанию энергии орбитали можно расположить в следующий ряд: 1s<2s<2p<3s<3p<4s»3d<4p... и т. д. По принципу запрета Паули на орбитали не может находиться более двух электронов, характеризующихся одинаковым набором из четырех квантовых чисел. По правилу Хунда на вырожденных орбиталях электроны располагаются с максимально возможным значением суммарного спинового квантового числа. Электронные орбитали обозначаются обычно O, ÿ и — , а электроны . На основании указанных принципов распределение электронов по электронным орбиталям в атомах любого элемента можно представить в виде электронных формулnl x , где n - главное квантовое число указывается цифрой, l - орбитальное квантовое число указывается буквамиs, p, d, f, x - число электронов на данной орбитали. Электронное строение атома тесно связано со структурой периодической таблицы. Каждый период начинается с s-элемента и заканчивается инертным газом. В периоде происходит последовательное заполнение электронами одной из электронных орбиталей. Поскольку число электронов на орбитали ограничено, начинает заполняться более высокая по энергии орбиталь. Следующий период также будет начинаться с s-элемента и заканчиваться инертным газом. Элементы, у которых конфигурация внешних орбиталей одинакова, называются электронными аналогами. Они образуют группу в периодической таблице. Периодичность химических свойств элементов и их соединений связана с существованием предельной емкостиэлектронных орбиталей и периодическом воспроизведениианалогичных валентных конфигураций орбиталей на все более высоком энергетическом уровне. СПИCOK рекомендуемой ЛИТЕРАТУРЫ 1. Г.П.Лучинский.Курс химии. М.;Высшая школа,1985. 2. Н.Л .Глинка. Общая химия. Л.: Химия, 1984-88.
Практическая работа . Фамилия, имя, отчество студента Шевченко Павел Александрович--------------------------------------------- -------------------------------------------- Шифр -------------------
Электронное строение атомов химических элементов и структура периодической таблицы
1. Получите у преподавателя задание с названием элемента .
Элемент: названиеHf символ ------------------ -----------------
2. По периодической таблице определите порядковый номер элемента Z и количество электронов в атоме химического элемента Zе Порядковый номер элемента Z= _72____ Количество электронов в атоме химического элемента Z e = _______
3. Определите номер периода,в котором находится Ваш элемент, и все возможные значения главного квантового числа n для атомов Вашего химического элемента. Номер периода элемента _______ Значения главного квантового числа для атомов химического элемента n = 6 ______________
*к пп.2,3*
4. Расположите в ряд все возможные орбитали атомов Вашего элемента в порядке возрастания значений главного квантового числа. Символ элемента 1,2,3,4,5,6 Hf _____ Ряд возможных орбиталей атомов элемента ___1s,2s,2p,3s,3p,3d,4s,4p,4d,4f,5s,5p,5d,5f,5g,6s,6p,6d,6f,6g,6h ____________________________________________________
*к пп.4*
5. Расположите в ряд те же орбитали атомов Вашего элемента в соответствии с принципом наименьших энергий. Расположение орбиталей в соответствии с принципом наименьших энергий проведите на основании расчетных данных таблицы 1. Таблица 1.
Символ элемента hf_______ Ряд возможных орбиталей атомов элемента _1s,2s,2p,3s,3p,4s,3d,4p,5s 4d 5p 6s 4f 5d 6p 5f 6d 5g 6f 6g 6h ____________________________________________________
6. Дайте развернутую электронную формулу обоих элементов в соответствии с принципом наименьших энергий ( пункт 5 ). Символ элемента _Hf
_______
Электронная формула элемента _1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 _______________________________________________________ Если в электронной формуле имеются полностью заполненные d - и f- орбитали ( d10 и f 14 ), то в электронных формулах расположите эти орбитали в порядке возрастания значений их главного квантового числа n. (пункт 4 ). Напишите окончательную электронную формулу Вашего элемента. Символ элемента Hf _______ Электронная формула элемента _1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4f14 5s2 5p6 6s2 5d2 __________________________________________________________
7. Определите валентную электронную конфигурацию и тип электронного семейства Вашего элемента на основании его электронной формулы. Символ элемента Hf________ Валентная электронная конфигурация элемента _6s2 5d2_______ Элемент относится к d____ электронному семейству.
8. Дайте графическое изображение орбиталей Вашего элемента с расположенными на них электронами. Графическое изображение орбиталей элемента
Символ элементаHf______ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ 6p ¯ ¯ ¯ ¯ ¯ ¯ ¯ 5d ¯ 4f ¯ ¯ ¯ 6s ¯ ¯ ¯ ¯ ¯ 5p 4d ¯ ¯ ¯ ¯ 5s ¯ ¯ ¯ ¯ ¯ 4p 3d ¯ ¯ ¯ ¯ 4s 3p ¯ 3s ¯ ¯ ¯ 2p ¯ 2s ¯ 1s
9. Напишите значения всех четырех квантовых чисел для валентных электронов Вашего элемента в таблицу2. Таблица 2
10. Рассчитайте суммарные спиновые квантовые числа валентных электронов Вашего элемента. Символ элемента _Hf______ Валентная электронная конфигурация элемента ______________ Суммарные спиновые квантовые числа валентных электронов элемента Sms: для s - валентных электронов _0______________ для p - валентных электронов _______________ для d- валентных электронов __1____________ для f - валентных электронов ______________
11. Покажите процесс ионизации атомов Вашего элемента с помощью электронных формул. Символ элемента ____Hf__ - 1 e = _Hf+_____катион элемента Валентная электронная конфигурация атома элемента _6s2 5d2____________________
Валентная электронная конфигурация катиона элемента __6s2 _5d1________________
12. Покажите процесс возбуждения атомов Вашего элемента с помощью электронных формул. Символ элемента Hf______ + E*®символ возбужд. атома элемента__Hf*____ Валентная электронная конфигурация атома элемента _6s2 5d2 _________ Валентная электронная конфигурация возбужденного атома элемента 6s1 5d3______________________
13. Укажите формы электронных облаков для валентных электронов Вашего элемента.
*****************************************************************************
ЗАДАНИЕ ПО ТЕМЕ: “Электронное строение атомов химических элементов и структура периодической таблицы “
1. Получите у преподавателя задание с названием двух элементов . Первый элемент: название символ Фосфор_______ _P____ Второй элемент: название символ Марганец _______ __Mn___ 2. Определите порядковый номер элемента Z и количество электронов в атоме химического элемента Zе Порядковый номер первого элемента Z1= 15_____ Количество электронов в атоме первого элемента Z e1 = __15_____ Порядковый номер второго элемента Z2 = 25_____ Количество электронов в атоме второго элемента Ze 2= _25____
3. Определите номер периода,в котором находятся Ваши элементы и все возможные значения главного квантового числа n для атомов Ваших химических элементов. Номер периода первого элемента 3_______ Значения главного квантового числа для атома первого химического элемента n = _3_____ Номер периода второго элемента 4_____ Значения главного квантового числа для атома второго элемента n=4
4. Расположите в ряд все возможные орбитали атомов Ваших элементов в порядке возрастания значений главного квантового числа. Символ первого элемента P_____ Ряд возможных орбиталей атомов первого элемента ____________1s2s2p3s3p3d___________________________________________ Символ второго элемента Mn_____ Ряд возможных орбиталей атомов второго элемента ____________________________1s2s2p3s3p3d4s4p4d4f ___________________________ 5. Расположите в ряд те же орбитали атомов в соответствии с принципом наименьших энергий. Расположение орбиталей в соответствии с принципом наименьших энергий проведите на основании расчетных данных таблицы 1. Таблица 1.
Символ первого элемента __P_____ Ряд возможных орбиталей атомов первого элемента ____________1s2s2p3s3p4s3d_________________________________________ Символ второго элемента ___Mn____ Ряд возможных орбиталей атомов второго элемента ____________1s2s2p3s3p4s3d4p4d4f_________________________________________
6. Дайте развернутую электронную формулу обоих элементов в соответствии с принципом наименьших энергий ( пункт 5 ). Символ первого элемента P________
Электронная формула первого элемента _______________1s22s22p63s23p3_________________________________________
Символ второго элемента Mn________ Электронная формула второго элемента _____________1s22s22p63s23p64s23d5____________________________________________ Если в электронной формуле имеются полностью заполненные d - и f- орбитали ( d10 и f 14 ), то в электронных формулах расположите эти орбитали в порядке возрастания значений их главного квантового числа n. (пункт 4 ). Напишите окончательные электронные формулы Ваших элементов. Символ первого элемента _______ Электронная формула первого элемента ___________________________________________________________ Символ второго элемента ________ Электронная формула второго элемента ___________________________________________________________
7. Определите валентную электронную конфигурацию и тип электронного семейства Ваших элементов на основании их электронных формул. Символ первого элемента P________ Валентная электронная конфигурация первого элемента __3s23p3______ Первый элемент относится к p____ электронному семейству. Символ второго элемента Mn________ Валентная электронная конфигурация второго элемента _4s23d5_______ Второй элемент относится к d______ электронному семейству.
8. Дайте графическое изображение орбиталей Ваших элементов с расположенными на них электронами. Графическое изображение орбиталей первого элемента
Символ первого элемента_P_____ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ 6p ¯ ¯ ¯ ¯ ¯ ¯ ¯ 5d ¯ 4f ¯ ¯ ¯ 6s ¯ ¯ ¯ ¯ ¯ 5p 4d ¯ ¯ ¯ ¯ 5s ¯ ¯ ¯ ¯ ¯ 4p
3d ¯ ¯ ¯ ¯ 4s 3p ¯ 3s ¯ ¯ ¯ 2p ¯ 2s ¯ 1s Графическое изображение орбиталей второго элемента
Символ второго элемента_Mn_____
¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ 6p ¯ ¯ ¯ ¯ ¯ ¯ ¯ 5d ¯ 4f ¯ ¯ ¯ 6s ¯ ¯ ¯ ¯ ¯ 5p 4d ¯ ¯ ¯ ¯ 5s ¯ ¯ ¯ ¯ ¯ 4p 3d ¯ ¯ ¯ ¯ 4s 3p ¯ 3s ¯ ¯ ¯ 2p ¯ 2s ¯ 1s 9. Напишите значения всех четырех квантовых чисел для валентных электронов Ваших элементов в таблицы 2-1 и 2-2. Таблица 2-1
Таблица 2-2
10. Рассчитайте суммарные спиновые квантовые числа валентных электронов Ваших элементов. Символ первого элемента _P______ Валентная электронная конфигурация первого элемента ______________ Суммарные спиновые квантовые числа валентных электронов первого элемента Sms: для s - валентных электронов _______________ для p - валентных электронов _3/2______________ для d- валентных электронов ______________ для f - валентных электронов ______________
Символ второго элемента _Mn_____________ Валентная электронная конфигурация второго элемента __________ Суммарные спиновые квантовые числа для валентных электронов второго элемента Sms : для s - валентных электронов __0_______ для p - валентных электронов _________ для d - валентных электронов __5/2_______ для f - валентных электронов _________
11. Покажите процесс ионизации атомов Ваших элементов с помощью электронных формул. Символ первого элемента P______ - 1 e = __P+____катион элемента Валентная электронная конфигурация атома первого элемента _____3s23p3________________
Валентная электронная конфигурация катиона первого элемента ______3s23p2_____________
Символ второго элемента _Mn______ - 1e = ___Mn+____ катион элемента Валентная электронная конфигурация атома второго элемента _____4s23d5______________
Валентная электронная конфигурация катиона второго элемента _____4s23d4______________
12. Покажите процесс возбуждения атомов Ваших элементов с помощью электронных формул. Символ первого элемента _P_____ + E*®символ возбужд. атома элемента__P*____ Валентная электронная конфигурация атома первого элемента ___3s23p3 _______ Валентная электронная конфигурация возбужденного атома первого элемента _______3s13p34s1_______________
Символ второго элемента _Mn_____ + E*® _____ символ возбужд. атома элемента__Mn*____ Валентная электронная конфигурация атома второго элемента _________4s23d5__________________
Валентная электронная конфигурация возбужденного атома второго элемента ____________4s13d54p1_______________
13. Укажите формы электронных облаков для валентных электронов Ваших элементов. Символ первого элемента __P______ Валентная электронная конфигурация атома первого элемента _____________________
Символ второго элемента ____Mn_____ Валентная электронная конфигурация атома второго элемента _______________
*****************************************************************************
*к пп.2,3* Порядковый номер “Z” химического элемента определяет его инвариантность, т.е. строго определенное место в периодической таблице. Физический смысл порядкового номера: показывает количество протонов в ядре атома и количество электронов в атоме. Номер периода. Период - горизонтальный ряд химических элементов в периодической таблице, расположенных в порядке возрастания порядкового номера. Номер периода показывает максимальное значение главного квантового числа “n”. Например. Элемент расположен в 7 периоде. Максимальное значение главного квантового числа n = 7. В атоме элемента существуют орбитали со следующими значениями главного квантового числа: 1,2,3,4,5,6,7. *****************************************************************************
*к пп.4* Таблица 1.
Числовые значения орбитального квантового числа l и соответствующие им буквенные обозначения:
Таблица 2.
Возможные типы электронных орбиталей для данного значения главного квантового числа “n”
Пример. Элемент расположен в 7 периоде. Расположите в ряд все возможные электронные орбитали атомов Вашего элемента в порядке возрастания значений главного квантового числа. Решение. Возможные электронные орбитали данного элемента: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g6s6p6d6f6g6h7s7p7d7f7g7h7j 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 __да________
__да________
 __нет_________
__нет_________
 ___нет__________
___нет__________
 __нет______________
__нет______________
 ____________________да_____
____________________да_____
 ______да________
______да________
 ____нет________
____нет________
 ___нет__________
___нет__________
 ___нет_________
___нет_________
 ____да____
____да____
 _________
_________
 _________
_________
 _________
_________
 _______
_______
 _______
_______
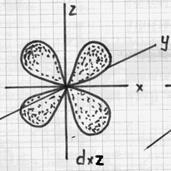 ________
________
 __________
__________
 _________
_________
 _________
_________
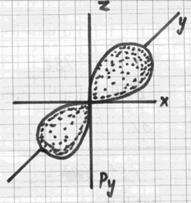 _________
_________
 _________
_________
 _______
_______
 __________
__________
 _________
_________