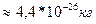|
|
Температура. Энергия теплового движения молекул.Как надо решать задачи по физике. Чтобы правильно и осмысленно решать задачи по физике, необходимо следовать алгоритму: Алгоритм «Решение задач по физике» 1. Внимательно прочитайте условие задачи. 2. Установите о каком (их) физических явлениях идёт речь в задаче. 3. Вспомните основные количественные и качественные закономерности, объясняющие это (и) явление. 4. Определите, что требуется найти в задаче. 5. Установите, какие физические величины даны в задаче. Не забудьте о табличных величинах. Примечание: Иногда использование табличных величин зашифровано текстовой информацией: -определить массу молекулы азота, -найти количества вещества в массе алюминия. 6. Переведите, если этого необходимо, физические величины в систему СИ (стандартные единицы измерения) 7. Определите какую (ие) количественную (ые) зависимость (и) надо использовать в решение. Для этого лучше всего определить количественные зависимости, куда входит искомая физическая величина, а также данные физических величин по условию задачи. 8. Использовать преобразования в физических формулах, получите окончательную расчётную формулу. Примечание: при проверке правильности полученной формулы используйте размерность физической величины. Например: Если мы должны найти силу F, то в результате сокращения размерности должны получить H (Ньютон), если получить, что-то другое, значит, формула получена не верно. 9. Выполните вычисления по полученной формуле. 10. Запишите ответ задачи. Примечание: Иногда, для успешного решения задачи требуется выполнить чертёж. Помните о том, что правильно выполнит чертёж, помогает в решение задач, это 50% вашего успеха. 2. Основы молекулярно-кинетической теории. Основные понятия и закономерности. В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Относительно молекулярной (или атомной) массой вещества Мr называют отношение массы молекулы (или атома) m В Международной системе единиц количество вещества выражают в молях. Один моль- это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг. Значит, в 1 моле любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают N Между молярной массой Μ и относительной молекулярной массой Mr существует следующая связь: M=Mr⋅10−3 Следующей основной физической величиной в МКТ будет – количество вещества. Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода 126C. Единица количества вещества называется молем(моль). Обозначают количесвта вещества –ν. Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА: ν = N/ NА = m\M Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества) N=νNA=mMNA. Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы: m0=M\NA=mN. Броуновское движение-это тепловое движение взвешенных в жидкости (или газе) частиц. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. p Это основное уравнение молекулярно-кинетической теории. p Решение задач Задача 1. Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг?[2]
M(Al)=27 m (Al)=5,4 кг
Задача 2. Какой объем занимает 100 моль ртути?
M(Hg)=201
Задача 3. Чему равно число молекул в 10 г. кислорода? Дано СИ Решение
M(O
N-? Ответ: Задача 4. На изделие, поверхность которого 50 см
S=50 cм
Na=6.02*10
N= Ответ: Задача 5. Определите сколько молекул воды в объёме 2л. Дано СИ Решение
Na=6.02*10
N-? Ответ: Задача 6. Находившаяся в стакане воде массой 0,5 кг. полностью испарилась за 30 суток. Сколько в среднем молекул воды вылетало с её поверхности за 1с? Дано СИ Решение
t=30 суток 2,592·10 t
N
Ответ: Задача 7. В озеро, имеющее среднюю глубину 10м и площадь поверхности 20 км Дано СИ Решение h=10м Чтобы найти N
m=0.01 г 10 V Na=6.02·10
Р -? Задача 9. Какова средняя квадратичная скорость движения молекул газа, если имея массу 8 кг, он занимает объем 10 м Дано СИ Решение
V=10 м
V-? 2. Разделим первую и вторую часть на m: V 3. Возьмем квадратичный корень из первой и второй части. V= V= Ответ: 306 м/с Задача 10. Найти концентрацию молекул кислорода, если давление его 0,3 МПа, а средняя квадратичная скорость молекул равна 900
V=900
n-? n= Ответ: Задача 11. Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении 30 кПа. Концентрация молекул газа при указанном давление 5*10
P=30 кПа 3*10
Е Температура. Энергия теплового движения молекул. Основные понятия и закономерности. Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел(V,p,Т) называют макроскопическими параметрами. Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру. Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют нулем температуры. Постоянная Больцмана связывает температуру 0 в энергетических единицах с температурой Т в Кельвинах. Один Кельвин и один градус шкал Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию. T=t+2730С; Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре. Решение задач. Задача 1. Определить кинетическую энергию молекулы одноатомного газа и концентрацию молекул при температуре 37
T=37 P=1,2 МПа 1,2*10 к=1,38*10
n= Ответ: Задача 2. Найти температуру водорода и среднюю квадратичную скорость его молекул при давлении 150 кПа и концентрации молекул 1,5*10 Дано СИ Решение P=150 кПа 1.5*10
k=1,38*10 Na=6.02*10
уравнение (2) V= V= Ответ: Задача 3. При какой температуре средняя квадратичная скорость молекул равна 700
Дано СИ Решение
К=1,38*10 Na=6.02*10
Т-? Итак, Т= молекулы кислорода. Найдем её, зная молекулярную массу кислорода: Ответ: Задача 4. Средняя квадратичная скорость молекул газа, находящихся при температуре 110 Дано СИ Решение t=110 V=600 к=1,38*10
2.Умножим обе части на m 3. Разделим обе части на V Вычислим: m 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 данного вещества к
данного вещества к  массы атома углерода m
массы атома углерода m  : Mr =
: Mr = 
 и называют постоянной Авогадро в честь итальянского учёного.
и называют постоянной Авогадро в честь итальянского учёного.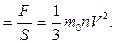

 [1]
[1]
 Дано СИ Решение
Дано СИ Решение
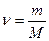
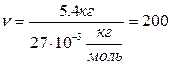 моль
моль .
.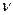 -? Ответ: 200 моль.
-? Ответ: 200 моль.
 Подставим
Подставим  в первую формулу
в первую формулу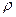 (Hg)=13.6·10
(Hg)=13.6·10 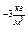 V=
V=  =1,5 ·10
=1,5 ·10  м
м 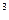
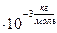
 V-? Ответ: 1,5·10
V-? Ответ: 1,5·10 
 m (O
m (O 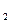 )=10 г. 0,01кг.
)=10 г. 0,01кг.  (1)
(1) 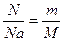
 Выразим N; получаем
Выразим N; получаем 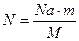
 Na=6.02·10
Na=6.02·10  моль
моль  N=
N= 
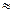 1,88·10
1,88·10  , нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
, нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии? Дано СИ Решение
Дано СИ Решение

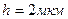
 N= , но масса цинка не известна.
N= , но масса цинка не известна. Найдём массу цинка через объём и плотность.
Найдём массу цинка через объём и плотность.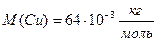
 , объём найдём, зная площадь поверхности
, объём найдём, зная площадь поверхности Подставим в начальную формулу
Подставим в начальную формулу N-?
N-?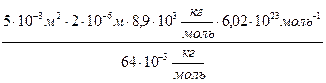
 молекул
молекул
 V=2л. 2*10
V=2л. 2*10  N=
N=  , масса воды неизвестна.
, масса воды неизвестна. Найдём массу воды через объём и плотность. m=
Найдём массу воды через объём и плотность. m= 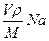


 N=
N= 

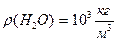
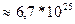

 m(H
m(H  )=0.5 кг. N
)=0.5 кг. N  =
=  Чтобы найти число молекул, испаряющихся за
Чтобы найти число молекул, испаряющихся за с. 1сек. - N
с. 1сек. - N  =18·10
=18·10 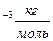 . N=
. N=  Подставим(2)
Подставим(2)  (1) и учтем время в секундах.
(1) и учтем время в секундах. N
N 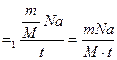
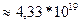

 S=20 км
S=20 км 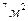 частиц соли N V=hS(1); N=
частиц соли N V=hS(1); N=  ; N
; N 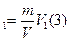
 Подставим (1) и (2) в (3)
Подставим (1) и (2) в (3) 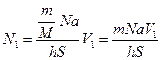

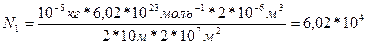
 N
N 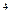
 Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600
Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600  , а его плотность 1,54
, а его плотность 1,54  ?
? Дано СИ Решение
Дано СИ Решение
 Отразим на произведение m
Отразим на произведение m 


 Следовательно,
Следовательно, 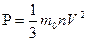
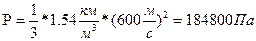 Ответ:1,848*10
Ответ:1,848*10 

 m=8кг
m=8кг 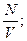
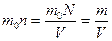 Следовательно,
Следовательно, 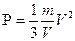
 2,5*10
2,5*10  1. Умножим первую и правую части на 3V: 3РV=mV
1. Умножим первую и правую части на 3V: 3РV=mV 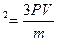
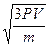
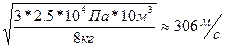

 Дано CИ Решение
Дано CИ Решение
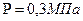 3*10
3*10  Для этого воспользуемся малярной массой кислорода
Для этого воспользуемся малярной массой кислорода Na=6,02*10
Na=6,02*10 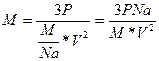
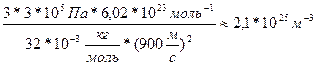
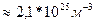
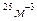 .
.
 Дано СИ Решение
Дано СИ Решение Eк
Eк  E
E 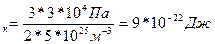
 N=5*10
N=5*10  -? Ответ:9*10
-? Ответ:9*10 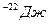
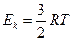
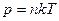
 [3]
[3] С и давлении 1,2 МПа.
С и давлении 1,2 МПа.
 Дано СИ Решение
Дано СИ Решение . Е
. Е  Выразим из (2)уравнения n=>n=
Выразим из (2)уравнения n=>n= 
 Итак: Е
Итак: Е  и n=
и n=  Е
Е 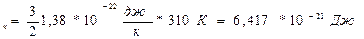

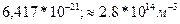
 Па P=nКТ (1) . Выразим Т из Уравнения (1): Т=
Па P=nКТ (1) . Выразим Т из Уравнения (1): Т= 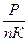

 N=1,5*10
N=1,5*10  724 К; V=
724 К; V=  (2)
(2) Масса молекулы водорода неизвестна. Найдем его,
Масса молекулы водорода неизвестна. Найдем его,
 Подставим выражение (3) в
Подставим выражение (3) в Т-? V-? .
Т-? V-? .
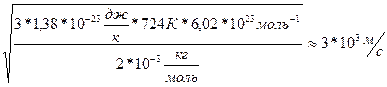
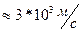

 V=700
V=700 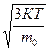 (1). Выразим из уравнения(1)поэтапно
(1). Выразим из уравнения(1)поэтапно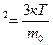
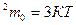

 3.Разделим обе части на 3К: Т=
3.Разделим обе части на 3К: Т= 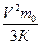
 , но мы не знаем m
, но мы не знаем m 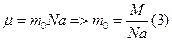 Подставим (3) в (2), получим:
Подставим (3) в (2), получим:  Т=
Т= 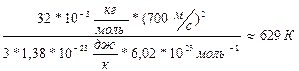
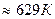

 Т=t+273К ; Т=110
Т=t+273К ; Т=110  Выразим m
Выразим m  m
m 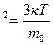
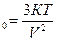
 Ответ:
Ответ: