
|
|
РАЗДЕЛ IV. ЭНЕРГЕТИЧЕСКИЙ ОБМЕНПО ТЕХНИКЕ БЕЗОПАСНОСТИ ДЛЯ СТУДЕНТОВ ПРИ РАБОТЕ В ЛАБОРАТОРИЯХ
1. К работе в лабораториях допускаются студенты, прошедшие инструктаж по работе с реактивами и биопсийными материалами. 2. В лабораториях кафедры разрешается работать только в халате с длинными рукавами. Длинные волосы должны быть подобраны. 3. Все процедуры при выполнении работ по приготовлению препаратов, отмериванию реактивов (их переливание) должны проводиться только на своём рабочем месте на столе (или в вытяжном шкафу). Нагревание реактивов открытым огнём производится в специально оборудованном вытяжном шкафу. Запрещается проводить какие-либо манипуляции с реактивами над полом. 4. Необходимо соблюдать большую осторожность при работе с крепкими кислотами и щелочами (10% и выше). Особая аккуратность и осторожность необходимы при работе с концентрированными кислотами и щелочами, а также с другими агрессивными веществами (уксусный ангидрид, фенол, пергидроль и др.). Запрещается отмеривать такие реактивы путём подсасывания их ртом во избежание химического ожога полости рта. Отмеривание таких реактивов необходимо производить с помощью сифона или пипетки. Следует остерегаться попадания указанных реактивов на кожу (ожоги) и на одежду (разъедание тканей). Работу с этими веществами следует проводить в резиновых перчатках. При разбавлении крепких кислот для предупреждения разбрызгивания следует добавлять кислоту в воду, а не наоборот. 5. Пролитую щелочь надо засыпать песком или опилками. Затем песок или опилки убрать и это место залить сильно разбавленной кислотой (соляной, уксусной). Пролитую кислоту следует засыпать песком (опилками нельзя), затем песок убрать лопатой и засыпать содой, потом удалить соду и промыть это место большим количеством воды (в резиновых перчатках). 6. При нагревании пробирок в пламени горелки возможно бурное вскипание и выброс содержимого на расстояние до 2-3 м, что особенно опасно в случае попадания кипящих брызг в лицо и глаза. Для предупреждения подобных случаев нагревание пробирок следует проводить у мениска жидкости, а не у дна, непрерывно вращая их и периодически вынимая из пламени. Надо следить, чтобы отверстие пробирки не было направлено на себя или на кого-нибудь из находящихся в лаборатории. Нельзя закрывать горячий раствор пробкой до полного остывания. 7. При сжигании (минерализации) органических веществ в колбах Къельдаля, при гидролизе белка, при анализе мочи, при работе с фенолом, уксусным ангидридом, хлористым бензолом, нитробензолом, анилином и другими подобными веществами в воздухе накапливаются раздражающие пары. Все указанные работы необходимо проводить в вытяжном шкафу. 9. Нельзя оставлять без присмотра горящие спиртовки. Запрещается держать вблизи открытого огня вату, марлю, спирт и другие легко воспламеняющиеся вещества. 10. При работе с центрифугой необходимо плотно закрывать крышку и запирать её на замок. Увеличивать скорость вращения можно лишь постепенно. Открывать крышку разрешается только после полной остановки ротора. 11. К работе на электромедицинской аппаратуре допускаются лица, изучившие инструкцию по безопасным приёмам работы, приложенную к аппарату. Запрещается работать на аппаратуре, имеющей электрический пробой, нарушенную проводку, не имеющую заземления (кроме гальванической доски и низковольтной аппаратуры - 24-вольтовой сети). При прекращении подачи электрического тока необходимо выключить все электроприборы. 12. Все вопросы по технике безопасности, возникающие в процессе работы, следует немедленно выяснить у преподавателя или лаборанта. СОДЕРЖАНИЕ ЗАНЯТИЯ I. Теоретическая часть. I.1.Контроль исходного уровня знаний. I.2.Обсуждение основных вопросов темы. I.3.Тестовый контроль. II. Практическая часть. II.1.Выполнение лабораторных работ. II.2.Самостоятельная работа с методическим материалом. II.3.Оформление результатов работы. III. Заключительная часть. III.1.Анализ полученных результатов. III.2.Индивидуальный отчет по лабораторной работе. III.3.Задание к следующему занятию. III.4.Индивидуальная работа преподавателя со студентами.
МАТЕРИАЛ ДЛЯ САМОПОДГОТОВКИ
I. ЛИТЕРАТУРА А) обязательная 1. Т.Т.Березов, Б.Ф.Коровкин //Биологическая химия. М.: Медицина, 2002. Б) дополнительная 1. Т.Л.Алейникова, Г.В.Рубцова, Н.А.Павлова //Руковод-ство к практическим занятиям по биохимии.М.:Медицина, 2000.-126с. 2. Биохимия. //Под ред. Е.С.Северина. М.,Геотар-мед, 2003.-779с. 3. Горбунова В.Н., Баранов В.С. //Введение в молекулярную диагностику и генотерапию наследственных заболеваний. С.-Петербург:«Спец. лит-ра», 1997.-286с. 4. Климов А.Н., Никульчева Н.Г. //Обмен липидов и липопротеидов и его нарушения. С.-Петербург:«Питер», 1999.-505с. 5. Кольман Я., Рем К.-Г. //Наглядная биохимия. М.: Мир, 2000.-470с. 6. Крю Ж. // Биохимия. Медицинские и биохимические аспекты. М.: Медицина, 1979. 7. Ленинджер А. //Основы биохимии. М.: Мир, 1985.- т.I - III. 8. Марри Р. и др. //Биохимия человека. М.: Мир, 1993.-тт.I, II. 9. Молекулярная клиническая диагностика. Методы. //Под ред.С.Херрингтона и Дж.Макги.М.: Мир, 1999.-560с. 10. Мецлер Д. //Биохимия. М.: Мир, 1980.- тт.I - III. 11. Николаев А.Я. //Биологическая химия. М.:Высшая школа, 1998. 12. Пустовалова Л.М.//Практикум по биохимии. Ростов на Дону: Изд-во Феникс, 1999.-544с. 13. Сборник тестов и задач по биохимии. //Под ред. акад. И.П.Ашмарина. М.: Изд-во МГУ, 1996.234с. 14. Страйер Л. //Биохимия. М.: Мир, 1984.-тт.I - III. 15. Строев Е.А. //Биологическая химия. М.: Высшая школа,1989. 16. Уайт А. и др. //Основы биохимии. М.: Мир, 1981.-тт.I - III. 17. Щербак И.Г. //Биологическая химия. С-Пб.: Изд-во СПбГМУ, 2005.-480с. 18. Элементы патологической физиологии и биохимии. //Под ред акад. И.П.Ашмарина. М.:Изд-во МГУ, 1997. – 237с. 19. Эллиот В., Эллиот Д. //Биохимия и молекулярная биология. М.:Изд-во НИИ Биомед.химии РАМН, 1999.-373с.
II. КОНСПЕКТЫ ЛЕКЦИЙ III. МЕТОДИЧЕСКИЙ МАТЕРИАЛ: тематические папки, таблицы, плакаты и пр.
КРИТЕРИИ ОЦЕНКИ ЗНАНИЙ СТУДЕНТОВ
Студенту выставляется оценка:
ОТЛИЧНО - при глубоком знании программного материала, продемонстрированном: а) исчерпывающим ответом; б) грамотным свободным владением теорией при решении логических задач и практических заданий; в) знакомством с дополнительной литературой.
ХОРОШО - при твердом знании и грамотном изложении программного материала, отсутствии существенных неточностей в ответе, правильном применении теоретических положений в решении практических вопросов и задач.
УДОВЛЕТВОРИТЕЛЬНО - при знании только основных положений программного материала и недостаточном усвоении его деталей, характеризующимся неточностями формулировок, недостаточно грамотным и последовательным ответом, затруднением в решении задач.
НЕУДОВЛЕТВОРИТЕЛЬНО - при отсутствии знаний по значительной части программного материала, при существенных ошибках в ответе, неумении использовать теоретический материал при решении логических задач.
Ч А С Т Ь П Е Р В А Я
ОБЩИЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЖИВЫХ ОРГАНИЗМАХ
РАЗДЕЛ I. СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ
Занятие № 1 ТЕМА.БИОЛОГИЧЕСКАЯ РОЛЬ И ФИЗИКО-ХИМИ- ЧЕСКИЕ СВОЙСТВА БЕЛКОВ. МЕТОДЫ ВЫДЕЛЕНИЯ И ФРАКЦИОНИРОВАНИЯ БЕЛКОВ Цель занятия: 1.Повторить физико-химические и изучить биологические свойства белков. 2.Ознакомиться с методикой выделения белков. 3.Усвоить принцип разделения белков на фракции методом высаливания. Исходный уровень знаний: - кислоты и основания в органической химии; - химические свойства карбоксильной группы; - механизм нуклеофильного замещения у тригонального ато-ма углерода; - химические свойства аминогруппы: основность и нуклео- фильность; - строение, амфотерность и растворимость аминокислот; - коллоидные растворы и их свойства. Содержание занятия. I.2. Элементарный состав белков. Классификация и номенклатура аминокислот, входящих в состав белков. Функции белков. Характерные физико-химические свойства белков. Методы выделения и очистки белков.
II.1. Работа: ВЫСАЛИВАНИЕ БЕЛКОВ Высаливание - это осаждение белков с помощью больших концентраций нейтральных солей: NaCl, (NH4)2 SO4 и др. Принцип метода. Реакция высаливания обусловлена дегидратацией макромолекул белка с одновременной нейтрализацией электрического заряда. Для высаливания различных белков требуется определенная концентрация одних и тех же солей. При высаливании белок обычно не теряет своих нативных свойств. Он может, например, вновь проявлять ферментативную активность. Метод высаливания позволяет получить белки в кристаллическом виде и разделить белковую смесь на фракции, а именно: белки сыворотки крови - на альбумины (А) и глобулины (Г). Глобулины, имеющие большую молекулярную массу, высаливаются в полунасыщенном (50%), а альбумины - в насыщенном (100%) растворе сернокислого аммония. Хлористый натрий осаждает глобулины при полном насыщении (100%) раствора, а для осаждения альбуминов требуется еще и его подкисление. Высаливание белков является обратимой реакцией, т.к. осадок белка опять может раствориться после уменьшения концентрации солей диализом или разведением водой. Для определения белка в растворе используется универсальная биуретовая реакция. Химизм биуретовой реакции. Биуретовая реакция выявляет в белке пептидную ( -CO-NH- ) связь. В щелочной среде раствор белка при взаимодействии с ионами меди приобретает сине-фиолетовый цвет, а продукты его неполного гидролиза (пептоны) - розовое окрашивание. Биуретовую реакцию способны давать вещества, которые содержат не менее двух пептидных связей. Биуретовая реакция обусловлена образованием биуретового комплекса в результате соединения меди с пептидной группировкой белка. В щелочной среде лактимные формы образуются из лактамных форм. Биуретовая реакция схематично протекает так: H R2 O H R4 O | | || | | || Cu(OH)2+2NaOH
| || | | || | | R1 O H R3 O H R5 полипептид (лактамная форма)
R2 OH R4 OH | | | |
| | | | | R1 OH R3 OH R5 полипептид (лактимная форма)
R2 | R1-HC-C=N-CH-C=N-CH-R3 | | | |
|| Cu — ―N ↑ ¦ | R4-CH | | СOONa COONa | C -ОNа | | | || CH-NH2 CH-NH2
биуретовый медный комплекс медный комплекс с гистидином фиолетового цвета в случае биуретовой реакции
ПРИМЕЧАНИЕ: при постановке биуретовой реакции нельзя добавлять избыток сульфата меди, так как синий осадок гидрата окиси меди маскирует фиолетовое окрашивание биуретового комплекса белка.
Порядок выполнения работы.
ВЫВОД:
III.2.Контрольные вопросы. Какие факторы удерживают белки в растворе? Чем обусловлен коллоидный характер белковых растворов? На чем основаны реакции осаждения белков? Какие физико-химические свойства белков позволяют их фракционировать? Что такое высаливание? С помощью какой реакции можно выявить белок в растворе? Какую окраску имеют белковые и безбелковые растворы при проведении биуретовой реакции? Какие отдельные аминокислоты могут дать положительную биуретовую реакцию? Чем отличаются альбумины и глобулины?
Материал для самоподготовки. I а)1. с.19-49, II, III.
Занятие № 2
ТЕМА. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ. МЕТОДЫ ОЧИСТКИ БЕЛКОВ Цель занятия: 1.Изучить структурную организацию белковой молекулы как основу функционирования всех белков. 2.Ознакомиться с особенностями структуры фибриллярных белков. 3.Освоить методы очистки белков от примесей на примере диализа. Исходный уровень знаний: - аминокислоты: строение, классификация; - ковалентные и нековалентные связи: характеристика, при- меры; - физико-химические свойства белков. Содержание занятия. I.2. Строение глобулярных белков (первичная, вторичная, третичная, четвертичная структуры). Особенности строения молекулы фибриллярных белков. Взаимосвязь структуры и функции белков. Видовая специфичность первичной структуры и антигенные свойства белков. Методы очистки белков (хроматография, электрофорез, диализ и др.). Гидролиз белка (виды, условия, продукты полного и неполного гидролиза).
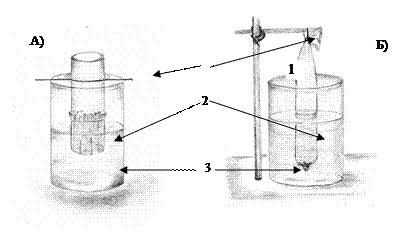
II.1. Работа: ДИАЛИЗ БЕЛКА Принцип метода. Диализ основан на способности полупроницаемых мембран пропускать сквозь поры низкомолекулярные вещества и задерживать высокомолекулярные коллоидные частицы. Ди-ализ является удобным методом очистки белков. При диализе коллоидный раствор помещают в коллодиевый или целлофановый мешочек и погружают в дистиллированную или водопроводную воду. Молекулы солей, сахаров и других низкомолекулярных веществ легко диффундируют через мембраны, а вещества коллоидной природы остаются в мешочке.
Рис. 1. Варианты устройства системы для диализа белка. А) диализатор из стеклянного цилиндра с дном из полупроницаемой мембраны. Б) диализатор из коллодиевого мешочка. 1-держатель, 2-диализуемый раствор, 3-диализат. Порядок выполнения работы. В коллодиевый мешочек (диализатор) налить 5 мл солевого раствора белка. Погрузить в стакан с дистиллированной водой на 1 час. Через час с небольшими порциями диализата (наружная жидкость) проделать реакции на хлориды и белок и убедиться в том, что минеральные соли продиффундировали во внешний сосуд, а белок остался в содержимом мешочка.
Проба на белок (биуретовая реакция).
ВЫВОД:
III.2. Контрольные вопросы. Что такое диализ? Что такое диализат и диализуемая жидкость? Какие реакции используются для контроля диализа? Как используется диализ в медицине?
Материал для самоподготовки. I а)1. с.26-32, 49-71; II; III.
Занятие № 3 ТЕМА.КЛАССИФИКАЦИЯ БЕЛКОВ. ХИМИЯ ПРОСТЫХ И СЛОЖНЫХ БЕЛКОВ. МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ Цель занятия: 1.Ознакомиться с классификацией белков, харак- теристиками отдельных групп белков и пептидов. 2.Освоить методы осаждения белков. Исходный уровень знаний: - строение и свойства белков; - биологическая роль белков. Содержание занятия. I.2. Характеристика основных групп простых белков. Принцип классификации сложных белков. Характеристика природных пептидов. Содержание белков и аминокислот в крови в норме и при патологии. I.3. Контрольная работа.
СВОДНЫЕ ВОПРОСЫ К КОНТРОЛЬНОЙ РАБОТЕ ПО РАЗДЕЛУ "СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ"
1. Определение класса белков. Элементарный состав, наименьшая структурная единица, молекулярная масса белков. 2. Классификация аминокислот, входящих в состав белков, основанная на полярности радикалов; примеры неполярных, полярных, положительно- и отрицательно заряженных аминокислот. 3. Амфотерность и растворимость аминокислот. Функциональные группы аминокислот, участвующие в образовании ковалентных, ионных, электростатических и гидрофобных (Ван-дер-Ваальса) связей белковой молекулы. 4. Структура и название аминокислот, производных пропионовой, масляной, валериановой, капроновой, янтарной и глутаровой кислот. 5. Структура и название окси- и серусодержащих, гомо- и гетероциклических аминокислот. 6. Факторы, удерживающие белок в растворе. Изоэлектрическая точка белков. Методы осаждения белков, значение для медицины. Обратимое и необратимое осаждение. Примеры. 7. Основные физико-химические свойства белков. Свойства коллоидных растворов, отличительные от свойств истинных растворов. Методы выделения и очистки белков. Диализ, значение для медицины. 8. Методы обнаружения белков в растворе и изучения качественного состава белка. Гидролиз белка, виды гидролиза, промежуточные и конечные продукты. Применение белковых гидролизатов в лечебной практике. 9. Назовите трипептид, например:
H3C-CH-CH2-CH-CO-NH-CH-CO-NH-CH-COOH | | | | CH3 NH2 CH3 CH2 | CH2-S-CH3
NH2 (CH2)3 COOH | CH2NH2
10. Напишите трипептид: а) глицил-валил-изолейцин; б) лейцил-тирозил-гистидин; в) аланил-метионил-триптофан и т.п. 11. Белки - основа жизненных процессов. Значение работ А.Я.Данилевского, Э.Фишера, Л.Полинга в формировании представлений о строении белков. Уровни структурной организации белковой молекулы. 12. Первичная структура, формирующие её связи. Зависимость биологических свойств белков от характера аминокислотной последовательности в полипептидной цепи ( HbA, HbS ). 13. Конформация пептидных цепей в белках: вторичная и третичная структуры, связи, определяющие эти структуры. Об-ратимая и необратимая денатурация белков; причины, значение. 14. Высшая форма организации белковой молекулы - четвертичная структура. Кооперативные изменения конформации протомеров (на примере гемоглобина и миоглобина). 15. Зависимость функциональных свойств белков от их конформации. Способность к специфическим взаимодействиям ("узнавание") как основа функционирования всех белков. Антигенные свойства белков. 16. Биологические функции белков. Различия белкового состава органов. Изменение белкового состава при онтогенезе и болезнях. 17. Классификация белков. Химия сложных белков. Важ-нейшие представители простых и сложных белков в организме человека. 18. Структурные белки. Классификация, особенности строения, распределение в тканях. Самосборка многомолекулярных белковых структур на примере коллагеновых волокон.
II.1. Работа № 1. ОСАЖДЕНИЕ БЕЛКОВ ПРИ КИПЯЧЕНИИ Принцип метода основан на денатурации большинства белков при нагревании их растворов при температуре свыше 5О-6О0С, что приводит к потере растворимости, особенно в изоэлектрической точке. Почти все белки свертываются и осаждаются при нагревании в нейтральной и слабокислой среде. В сильнокислых и щелочных средах растворы белков при кипячении денатурируют, но не коагулируют и могут дать осадок лишь при добавлении достаточного количества какой-либо нейтральной соли (NaCl, сернокислый аммоний и др.). Устойчивость белка в растворе зависит от приобретения (+) заряда в случае сильнокислой среды и усиления (-) заряда в щелочной среде.
+H+ -H+
| | |
молекула заряжена цвиттерионная молекула заряжена "+" форма аминокислоты "-" рН = 2-3 рН = 4-9 рН = 9-10 (биполярная форма) При понижении рН диссоциация карбоксильной группы подавляется и молекула становится положительно заряженной. При повышении pH происходит отрыв связанного протона аминокислоты и молекула приобретает отрицательный заряд. Более полное и быстрое осаждение происходит при достижении изоэлектрической точки. Изоэлектрической точкой называют такое значение рН, при котором суммарный электрический заряд белка равен нулю и, следовательно, белок при этом в электрическом поле теряет подвижность, т.е. остается на старте. Для большинства белков изоэлектрическая точка соответствует слабокислой среде (в пределах от 5,5 до 6,9). Итак, важную роль в денатурации белков при нагревании играет концентрация водородных ионов, т.е. определенная реакция среды, и присутствие солей. Порядок выполнения работы:
ВЫВОД:
Работа № 2a. ОСАЖДЕНИЕ БЕЛКОВ СОЛЯМИ ТЯЖЕЛЫХ МЕТАЛЛОВ Принцип метода. Осаждение белков солями тяжелых металлов в отличие от высаливания происходит при небольших концентрациях солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя солеобразные и комплексные соединения, растворимые в избытке этих солей (за исключением солей AgNO3, HgCl2), но нерастворимые в воде. Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного (+) заряда на частицах белка. Способность белка прочно связывать ионы тяжелых металлов в виде нерастворимых осадков в воде используется как противоядие при отравлении солями ртути, меди, свинца и др. Обычно применяют белки молока и яиц сразу после отравления, пока эти соли еще находятся в желудке и не успели всосаться. Вслед за введением белка у больного вызывают рвоту, чтобы удалить остатки яда из организма. Порядок выполнения работы.
ВЫВОД:
Работа № 2б. ОСАЖДЕНИЕ БЕЛКОВ КОНЦЕНТРИРОВАН- НЫМИ МИНЕРАЛЬНЫМИ КИСЛОТАМИ Принцип метода. Концентрированные минеральные кислоты вызывают денатурацию белка и образуют комплексные соли белка с кислотами. В избытке всех минеральных кислот, за исключением азотной, выпавший осадок белка растворяется. Качественная реакция с концентрированной HNО3 лежит в основе количественного определения белка в моче по методу Робертса-Столь-никова-Брендберга. Порядок выполнения работы:
ВЫВОД:
Рис. 2. Наслаивание пробы на концентрированную кислоту: 1 -раствор белка; 2-кислота.
III.2. Контрольные вопросы. Какие факторы удерживают белки в растворе? Чем обусловлена реакция осаждения белков? Что такое коагуляция белков? Виды коагуляции. Что такое денатурация белка? Виды денатурации. При каких условиях происходит: коагуляция с денатурацией; коагуляция без денатурации; денатурация без коагуляции? Что такое адсорбционная пептизация? Как используется в медицине реакция адсорбционной пептизации? Материал для самоподготовки: I а)1. с.19-74, 662-565. II, III.
РАЗДЕЛ II. ФЕРМЕНТЫ
Занятие № 4
ТЕМА. СТРОЕНИЕ И ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ Цель занятия: 1.Повторить материал по физико-химическим свойствам белков. 2.Ознакомиться с современными представлениями о структу- ре ферментов, изучить их характерные свойства. Исходный уровень знаний: - строение и физико-химические свойства белков; - понятие о катализаторах. Содержание занятия. I.2. Понятие о катализе. Химическая природа ферментов. Свойства ферментов. Строение ферментов (функциональные центры, их строение). Факторы, определяющие активность ферментов. Витамины как коферменты. Понятие об изоферментах. Мультимолекулярные ферментные системы.
II.1.Работа № 1.ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АКТИВНОСТЬ АМИЛАЗЫ СЛЮНЫ Принцип метода и химизм. Амилаза слюны (a-1,4-гликозидаза) катализирует гидролиз a-1,4-гликозидной связи крахмала и гликогена до дисахарида мальтозы с промежуточным образованием декстринов различного размера. Нерасщепленный крахмал с йодом дает синее окрашивание, амилодекстрины - фиолетовое, эритродекстрины - красно-бурое, ахродекстрины и мальтоза - желтое (цвет водного раствора йода, т.е. окрашивания с йодом не дают). Конечные продукты гидролиза крахмала - мальтоза и глюкоза - имеют свободную альдегидную группу и могут быть обнаружены реакцией Троммера, в основе которой лежит окислительно-восстановительная реакция. При нагревании альдегидная группа окисляется до глюконовой кислоты, а медь гидрата окиси меди (голубого цвета) - восстанавливается в гидрат закиси меди (желтого цвета). При дальнейшем нагревании образуется красная закись меди:
Одним из характерных свойств ферментов является термолабильность, т.е. чувствительность фермента к температуре. Для многих ферментов максимальная ферментативная скорость наблюдается при 38-400C. Эта температура называется температурным оптимумом. При нагревании свыше 700С они утрачивают свои свойства биологических катализаторов. Степень инактивирования зависит от длительности теплового воздействия. Замедление и прекращение ферментативной реакции происходит вследствие тепловой денатурации белковой молекулы фермента. При низких температурах ферменты не денатурируются, но скорость реакции резко снижается за счет снижения кинетической энергии молекул. О действии фермента судят по исчезновению субстрата или появлению продуктов реакции. Порядок выполнения работы: В чистую пробирку собрать примерно 2 мл нативной (неразведенной) слюны и кипятить в течение 5 минут, охладить.
ВЫВОД:
Работа № 2. ВЛИЯНИЕ РЕАКЦИИ СРЕДЫ НА АКТИВ- НОСТЬ ФЕРМЕНТОВ И ОПРЕДЕЛЕНИЕ ОПТИМУМА рН Принцип метода и химизм. Для разных ферментов существует свой оптимум рН среды, когда фермент наиболее активен. Например, оптимум рН пепсина (фермент желудочного сока) - 1,5-2,0; аргиназы (фермент печени) - 9,5. Для амилазы слюны оптимум рН - 6,8-7.2; в кислой и щелочной среде активность ее снижается за счет взаимодействия белковой молекулы с ионами раствора. Химизм реакции см. выше (раб. N1). Порядок выполнения работы: Слюну развести в 10 раз. Взять 5 пробирок и приготовить смеси в соответствии с таблицей (все растворы берутся в каплях).
ВЫВОД:
Работа № 3. СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ АМИЛАЗЫ СЛЮНЫ Принцип метода. Ферменты обладают специфичностью, т.к. способны катализировать только определённые химические реакции. Специфичность действия ферментов бывает абсолютная, относительная и стереохимическая. Она определяется тем, что только некоторые строго определённые функциональные группы, входящие в состав ферментов, могут участвовать в образовании фермент-субстратных комплексов. Амилаза слюны ускоряет гидролиз только полисахаридов, не оказывая действия на дисахариды. Мальтаза слюны ускоряет гидролиз образующегося дисахарида мальтозы и не оказывает действия на сахарозу. Химизм реакции см. в работе N 1. Порядок выполнения работы:
ВЫВОД:
III.2. Контрольные вопросы. Как и почему активность ферментов зависит от температуры? Что такое температурный оптимум ферментов? Как и почему активность ферментов зависит от рН среды (график)? Какие ферменты активны в кислой; нейтральной; щелочной среде? Что такое специфичность ферментов? Какие виды специфичности ферментов Вы знаете? Примеры. Укажите качественную реакцию на крахмал.
Материал для самоподготовки: I а) 1. с.44-49, 114-129, 139-143; II; III. Занятие № 5
ТЕМА. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ, КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ Цель занятия: Ознакомиться с современными представлениями о механизме действия ферментов и кинетике ферментативных реакций. Исходный уровень знаний: - белковая природа ферментов; - структура сложных ферментов; - строение молекулы фермента; - кинетика химических реакций. Содержание занятия. I.2. Современные представления о механизме действия ферментов (гипотеза Фишера, Кошланда). Полифункциональный катализ. Кинетика ферментативных реакций. Константа Михаэлиса. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 H2N-CH-C-N-CH-C-N-CH-C-N-CH-C-N-CH- .....
H2N-CH-C-N-CH-C-N-CH-C-N-CH-C-N-CH- ..... H2N-CH-C=N-CH-C=N-CH-C=N-CH-C=N-CH- ....
H2N-CH-C=N-CH-C=N-CH-C=N-CH-C=N-CH- ....
 H2N O O C-ONa
H2N O O C-ONa
 | CH2 CH2
| CH2 CH2
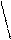

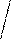








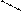 -CH2-CH-CO-NH-CH-CO-N
-CH2-CH-CO-NH-CH-CO-N | | |
| | |
 H3N+-CH-COOH H3N+-CH-COO- H2N-CH-COO-
H3N+-CH-COOH H3N+-CH-COO- H2N-CH-COO-

 H O
H O
 R R
R R