
|
|
Гидроксиды щелочных металлов
Соли Карбонат натрия Na2CO3 образует кристаллогидрат Na2CО3 ∙1ОН2О, известный под названием кристаллическая сода. Это вещество применяют в производстве стекла, бумаги, мыла, для устранения жесткости воды. Гидрокарбонат натрия NaHCО3. Применяют в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). Карбонат калия К2СО3. Техническое название — поташ. Используют в производстве жидкого мыла, тугоплавкого стекла, как калийное удобрение. Сульфат натрия Na2SО4 образует кристаллогидрат Na2SО4 ∙ 1ОН2О, известный под названием глауберова соль. Применяют для производства соды, стекла, как слабительное средство. Хлорид натрия NaCI, или поваренная соль, — важнейшее соединение не только натрия, но и хлора, о чем говорилось выше. Хлорид калия КСI и сульфат калия K2SО4 — ценные калийные удобрения. Нитрат калия KNО3 — сложное удобрение (содержит два питательных элемента), применяется также при изготовлении черного пороха и фейерверков. Окраска пламени. Соли щелочных металлов, как и сами металлы, окрашивают бесцветное пламя в характерные цвета: натрий — в желтый, калий — в фиолетовый.
Гидроксиды
Наиболее широко применяют гидроксид кальция. Это один из важнейших вяжущих материалов в строительстве, компонент шихты в производстве стекла, смягчитель воды. Гидроксид магния, наряду с гашеной известью, используют для очистки сахарных растворов. Он также входит в состав зубной пасты.
Соли Ортосиликат бериллия Be2SiО4 получают кристаллизацией расплава оксидов бериллия и кремния (используют в качестве искусственного поделочного ювелирного камня и как люминофор) 2ВеО + SiО2 = Be2SiО4. Стеарат магния (C17H35COO)2Mg, пальмитат магния (C15H31COO)2Mg, олеат магния (C17H33COO)2Mg. Мы привыкли называть мылами соли щелочных металлов и высших карбоновых кислот. В жесткой воде происходят обменные реакции, приводящие к образованию малорастворимых солей кальция и магния:
Подобные соли щелочноземельных металлов и магния также называют мылами, только «металлическими». Их нерастворимость в воде можно обратить на пользу: они применяются в качестве смазочных материалов, загустителей, компонентов косметических препаратов. Пропионат кальция (С2Н5СОО)2Са в пищевом производстве используют в качестве добавки, препятствующей образованию плесени. Его добавляют в хлебобулочные изделия, сыры, табак, консервированные овощи и фрукты. Хлорат бария Ва(СIO4)2 используют как компонент пиротехнических средств. Во-первых, он является очень сильным окислителем (как и все перхлораты), а во-вторых, все соли бария окрашивают пламя в зеленый цвет. Сульфид стронция SrS. Сульфиды щелочноземельных металлов, в том числе стронция, используют в качестве люминофоров, т. е. веществ, светящихся при возбуждении электромагнитным излучением. Сульфид стронция используют также для удаления волосяного покрова со шкур в кожевенном производстве. Подобно катионам щелочных металлов, щелочноземельные также окрашивают пламя в характерные цвета: кальций — в кирпично-красный, барий — в зеленый, стронций — в карминово-красный. Алюминий По распространенности в природе алюминий занимает третье место после кислорода и кремния, на его долю приходится 8,13% литосферы. Совместно с кремнием он образует такие известные породы и минералы, как алюмосиликаты, слюду, глину (нефелин и другие разновидности). Важное место из минералов занимает криолит Na3[AlF6], или 3NaF·AI F3. Многие природные вещества в качестве основного компонента содержат оксид алюминия: бокситы — основное сырье для производства алюминия; корунд — одно из самых твердых природных веществ; драгоценные камни (разновидности корунда) — рубин, сапфир и др. Для алюминия и всех соединений характерна единственно возможная степень окисления +3. Порошкообразный алюминий легко взаимодействует с неметаллами:
Очищенный от оксидной пленки алюминий способен взаимодействовать с водой
Способность вытеснять металлы из их оксидов — используют в металлургии:
Для получения высоких температур: при сгорании термитной смеси — смеси оксида железа (II, III):
С разбавленной азотной и соляной кислотами реагирует:
Алюминий используют для производства сплавов. Они легки, относительно прочны, электропроводны, коррозионноустойчивы. Порошок алюминия используется как краска «серебрянка», а также входит в состав пиротехнических средств. Безводный кристаллический оксид алюминия широко используют в хроматографии для очистки и разделения веществ. Оксид алюминия
Гидроксид алюминия
Соли. Галогениды алюминия хорошо растворимы в воде, в растворе гидролизуются по катиону. Бромид и иодид получают синтезом из простых веществ, хлорид алюминия — действием хлора на бокситы в присутствии восстановителя, например кокса:
Хлорид алюминия используют в качестве катализатора в органическом синтезе. Сульфат алюминия AI2(SО4)3 • 18Н2О используют для протравливания тканей перед окрашиванием, осветления и обесцвечивания воды. Если к раствору сульфата алюминия добавить сульфат калия, то при упаривании образуются кристаллы двойной соли: калий-алюминий сульфата KAI(SО4)2 ∙12Н2О. Подобные соли называются квасцами. Соли алюминиевых кислот — алюминаты, в нейтральной гидролизуются до гидроксида алюминия:
К природным алюминатам относится благородная шпинель Mg(AIО2)2, которая украшает историческую реликвию — корону российских императоров, и драгоценный хризоберилл Ве(АIO2)2. Одним из компонентов катализаторов Циглера—Натта является триэтилалюминий АI (С2Н5)3, который получают взаимодействием алюминия с этиленом в присутствии водорода:
Железо Основные минералы: магнитный железняк (магнетит) Fe3О4, красный железняк (гематит) Fe2О3, бурый железняк (лимонит) Fe2О3 • nН2О, сидерит FeCO3 и пирит (железный, или серный, колчедан) FeS2. В кислороде раскаленный порошок железа сгорает, разбрасывая красивые огненные звездочки, наподобие бенгальского огня. При этом образуется смешанный оксид железа (II, III) — железная окалина:
Во влажном воздухе железо довольно быстро окисляется с образованием гидратированного оксида железа (III) — ржавчины,
При действии перегретого пара на раскаленное свыше 6ОО °С железо также образуется железная окалина:
При действии соляной и разбавленной азотной кислоты железо окисляется до степени окисления:
В очень сильных окислительных средах (концентрированная азотная или серная кислоты) при комнатной температуре происходит пассивация железа. Однако при нагревании взаимодействие все-таки возможно:
Окислить свободное железо до степени окисления +6 удается не с помощью таких мощных окислителей, как концентрированная азотная кислота, а при сплавлении с нитратом калия и щелочью:
Железо способно образовывать нейтральный комплекс пентакарбонилжелезо:
Оксиды железа Известны FeO, Fe2О3 и смешанный оксид Fe3О4(FeO ∙ Fe2О3). Оксид железа (II) — черный порошок, пирофорен (в мелкораздробленном состоянии способен самовоспламеняться). Получить FeO не удается ни окислением железа, ни разложением соответствующего ему гидроксида Fe(OH)2 из-за того, что довольно трудно «поймать и зафиксировать» соединения железа в степени окисления +2. Получают оксид железа (II) разложением оксалата (соли щавелевой кислоты) или восстановлением оксида железа (III):
При нагревании оксид железа (III) восстанавливается водородом или оксидом углерода (II). Последняя реакция лежит в основе промышленного получения чугуна из железных руд:
Смешанный оксид получают:
Гидроксид железа (II)
Свежевыпавший осадок темнеет вследствие окисления:
Гидроксид железа (II) проявляет слабые амфотерные свойства с преобладанием основных:
Гидроксид железа (III) Более правильно рассматривать это соединение как гидратированный оксид mFe2О3∙пH2О. При нагревании это вещество переходит сначала в метагидроксид, а затем в оксид железа (III). Для того чтобы уравнение реакции было не так громоздко, допускается использовать формулу Fe(OH)3:
Соли
Сульфаты. FeSО4 ∙ 7Н2O — железный купорос — наиболее распространенная соль железа (II), на воздухе и в растворе постепенно окисляется. В присутствии сульфата аммония FeSО4 значительно более устойчив к окислению, а из водного раствора такой смеси выпадают кристаллы двойной соли (NH4)2Fe(SО4)2∙6Н2О, которую называют солью Мора и применяют в аналитической химии. Сульфат железа (III) также способен к образованию двойной соли, называемой железоаммонийными квасцами (NH4)Fe(SО4)2 ∙12Н2О. Ферраты. Соли щелочных металлов, содержащие феррат-анион (Na2FeО4, K2FeО4), имеют пурпурно-красную окраску, достаточно устойчивы в водных растворах, но при подкислении разлагаются:
Ферраты представляют собой даже более сильные окислители, чем перманганат калия, способны окислять аммиак до азота, а соединения хрома (II) — сразу до хромат-аниона: 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
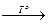 ВеО + СО2.
ВеО + СО2. Na[AI(OH)4(H2О)2].
Na[AI(OH)4(H2О)2].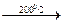 АIO(ОН) + Н2О и далее
АIO(ОН) + Н2О и далее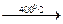 АI2О3 + Н2О.
АI2О3 + Н2О. [Fe(CO)5],
[Fe(CO)5],