|
|
Нарушение проведения импульсаТема. Аритмии. Нарушение возбудимости, автоматизма и проводимости сердца Нарушение ритма сердца. Классификация аритмий. Нарушения автоматизма, виды, причины, ЭКГ-признаки. Аритмия — типовая форма патологии сердца, характеризующаяся нарушением частоты и периодичности генерации возбуждения или последовательности возбуждения предсердий и желудочков. Виды аритмий.В соответствии с механизмом возникновения аритмий (патогенезом) все нарушения сердечного ритма можно условно подразделить на три типа: 1. нарушения автоматизма; 2. нарушения возбудимости; Нарушения проводимости. Подобное деление в известном смысле условно, потому что в реальности часто приходится сталкиваться с аритмиями сочетанного характера. Например, при фибрилляции желудочков и предсердий могут иметь место, как нарушение возбудимости, так и патология проведения сердечного импульса. Этиология аритмий Все причины аритмий можно условно подразделить на четыре группы: 1. Нарушения нейроэндокринной регуляции электрофизиологических процессов в кардиомиоцитах и клетках проводящей системы сердца (стресс, неврозы и др.); 2. органические поражения миокарда, его аномалии, врожденные или наследственные дефекты с повреждением электрогенных мембран и клеточных структур (миокардиты, пороки седца, кардиосклероз и др.); 3. сочетание нарушений нейрогуморальной регуляции ритма и органических заболеваний сердца (ИБС, реперфузионный синдром, поражение электрическим током и др.); 4. интоксикации, в том числе лекарственными препаратами (алкоголь, никотин, побочное действие ЛС и др.). Нарушения нейроэндокринной регуляции электрофизиологических процессов в кардиомиоцитах и клетках проводящей системы сердца. Одной из основных причин аритмий является изменение физиологического соотношения между тонической активностью симпатических и парасимпатических элементов, иннервирующих сердце. Одним из примеров нарушений ритма, обусловленных дисбалансом симпатического и парасимпатического звеньев вегетативной нервной системы, является снижение электрической стабильности сердца при психоэмоциональном стрессе. Известно, что высокие концентрации адреналина в крови, активируя β-адренорецепторы почечных канальцев, способствуют усилению экскреции К+ и развитию гипокалиемии. Гипокалиемия вызывает нарушения процессов реполяризации миокарда, создавая условия для развития аритмий. Роль эндокринных нарушений в патогенезе аритмий.Избыточная продукция тиреоидных гормонов способствует увеличению количества адренорецепторов в миокарде и повышению их чувствительности к эндогенным катехоламинам. По этой причине у больных тиреотоксикозом, как правило, наблюдаются тахикардия и нарушения сердечного ритма, обусловленные повышением адренореактивности сердца. Одной из частых «эндокринных» причин нарушений электрической стабильности сердца является избыточное образование минералокортикоидов в коре надпочечников (первичный и вторичный альдостеронизм). Реже аритмии возникают при гиперсекреции глюкокортикоидных гормонов (болезнь Иценко-Кушинга) или длительном приеме их фармакологических аналогов. Механизм аритмогенного эффекта минералокортикоидов (прежде всего, наиболее активного из них – альдостерона) связан с дисбалансом Na+/K+ в организме. Альдостерон, действуя на почечные канальцы, вызывает задержку в организме Na+ и усиление экскреции К+, в результате чего возникает гипокалиемия, которая способствует нарушению процессов реполяризации миокарда и возникновению аритмий. Аритмии, вызванные лекарственными препаратами. Часто причиной аритмий являются лекарственные препараты, обладающие собственной аритмогенной активностью. В первую очередь это относится к сердечным гликозидам и диуретикам. Мочегонные препараты, усиливая экскрецию калия, способствуют возникновению гипокалиемии. Сердечные гликозиды (дигиталис и др.) имеют свойство накапливаться в организме, ингибируя при этом Na+/K+-АТФазу, локализованную на сарколемме кардиомиоцитов. Снижение активности этого фермента сопровождается снижением уровня К+ и увеличением концентрации Na+ в саркоплазме. Накопление натрия в цитоплазме кардиомиоцитов приводит к усилению Na+/Ca2+-обмена, что сопровождается активным поступлением Са2+ в клетки миокарда и способствует усилению насосной функции сердца. Однако при этом формируется Са2+-перегрузка кардиомиоцитов. Кроме того, снижение внутриклеточной концентрации К+ вызывает замедление процессов реполяризации и тем самым способствует возникновению ранних деполяризаций и аритмий по механизму триггерного автоматизма. Основные виды аритмий сердца (патогенетическая классификация) I. Нарушение образования импульса: 1. Нарушение автоматизма: 1. номотопные аритмии (нарушение автоматизма СА-узла): синусовая тахикардия, синусовая брадикардия, синусовая аритмия, синдром слабости синусового узла; 2. гетеротопные аритмии (проявления автоматизма эктопических очагов): предсердный медленный ритм, атриовентрикулярный ритм, миграция наджелудочкового водителя ритма, идиовентрикулярный желудочковый ритм; 2. Нарушением возбудимости: 1. экстрасистолы (ЭС): предсердные, атриовентрикулярные, желудочковые; 2. пароксизмальная тахикардия: наджелудочковая, желудочковая; 3. трепетание предсердий и желудочков; 2. мерцание (фибрилляция) предсердий и желудочков; II. Нарушением проведения импульса: 1. синоатриальные блокады; 2. внутрипредсердные блокады; 3. атриовентрикулярные блокады; Внутрижелудочковые блокады. Последствия аритмий
Патогенез нарушений сердечного ритма
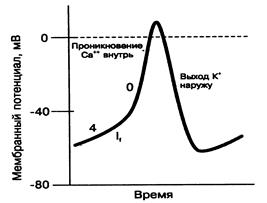
Основные механизмы нарушения сердечного ритма: 1. Нарушение образования импульса: 1.1. нарушение автоматизма, 1.2. нарушение возбудимости; 2. Нарушение проведения импульса; 3. Комбинированные нарушения образования и проведения импульса. Нарушение образования импульса Нарушение автоматизма Автоматизм— способность ткани сердца спонтанно генерировать потенциал действия (ПД). Нарушение автоматизма: 1. Нарушения нормального автоматизма – нарушение автоматизма СА-узла. 2. Появление аномального автоматизма – автоматизма, который обусловлен активацией пейсмекерной функции в клетках проводящей системы, не являющихся в норме водителями ритма (АВ-узел, ножки пучка Гиса, волокна Пуркинье). Клетки сердца по своим электрофизиологическим свойствам подразделяются на: клетки рабочего миокарда и клетки пейсмекера. Пейсмекер (от англ. pacemaker – водитель ритма) — клетки сердца, способные к спонтанной генерации импульса возбуждения. Наибольшей способностью к автоматии обладает синоатриальный узел (СА-узел). В условиях физиологической нормы в нем возникает возбуждение, которое благодаря проводящей системе сердца, последовательно охватывает предсердия и желудочки. Поэтому СА-узел называют водителем ритма сердца(I порядка),или пейсмекером. Пейсмекер может генерировать большую частоту возбуждений, чем другие участки проводящей системы. Он подавляет автоматию остальных волокон этой системы. Если СА-узел блокирован по каким-то причинам, то водителем ритма становится атриовентрикулярный узел(АВ-узел), который генерирует частоту возбуждений 40-50 в мин. Если водителем ритма станет пучок Гиса, то максимум частоты его возбуждений составляет 30-40 в мин. При такой частоте сокращений сердца даже в состоянии покоя у человека будут проявляться симптомы недостаточности кровообращения.Волокна Пуркинье могут генерировать до 20 импульсов в мин. Клетки пейсмекераобладают автоматизмом, то есть способностью к спонтанной деполяризации (рис. 1). Автоматизм клеток пейсмекера обусловлен особенностями проницаемости мембраны этих клеток и поляризации: 1. низким уровнем трансмембранного потенциала (МП= -60 мВ), 2. наличием спонтанной деполяризации. Эти свойства во многом определяются особенностями ионных каналов в мембранах клеток пейсмекера. Фаза 4 потенциала действия пейсмекерной клетки характеризуется постепенной, спонтанной деполяризацией (медленная спонтанная диастолическая деполяризация), вызванной пейсмекерным током (If). Пейсмекерный ток переносится преимущественно ионами Na+. Ионные каналы, через которые проходит пейсмекерный ток, отличаются от быстрых Na+ каналов, ответственных за фазу 0 деполяризации клеток рабочего миокарда. Пейсмекерные каналы открываются в период реполяризации клетки, когда МП достигает своего максимального отрицательного значения. Ток ионов Na+ через пейсмекерные каналы способствует тому, что мембранный потенциал (МП) во время фазы 4 становится все менее отрицательным и, при достижении порогового потенциала (~ -40 мВ), происходит возбуждение ПД (фаза 0). Фаза 0 пейсмекерной клетки наступает менее быстро, чем в кардиомиоцитах, так как она обусловлена током ионов Са2+ внутрь клетки через относительно медленные кальциевые каналы. Реполяризация пейсмекерных клеток развивается так же, как и клеток рабочего миокарда – происходит инактивация Са2+-каналов, активация К+-каналов, усиленный выход ионов К+ из клетки.
Рис. 1. Потенциал действия: А - кардиомиоцит; Б - клетка синоатриального узла: 0 – фаза быстрой деполяризации (овершут); 1 – фаза ранней быстрой реполяризации; 3 – фаза медленной реполяризации; 4 – фаза быстрой реполяризации.
Скорость медленной спонтанной диастолической деполяризации во многом определяет частоту генерации импульсов клетками-пейсмекерами: чем больше скорость спонтанной диастолической деполяризации, тем выше скорость генерации импульсов. Симпатические волокна выделяют норадреналин, который через β-адренорецепторы и систему посредников увеличивает содержания в клетке цАМФ, что приводит к возрастанию скорости диастолической деполяризации и тахикардии. Это влияние опосредуется через увеличение проницаемости мембран кардиомиоцитов для ионов Na+ и Са2+. Парасимпатические волокна посредством медиатора ацетилхолина и М2-рецепторы сердца оказывают обратный эффект – приводят к уменьшению скорости диастолической деполяризации, вызывают брадикардию. Под влиянием ацетилхолина увеличивается проницаемость мембран кардиомиоцитов для ионов К+ и снижается проницаемость их для Са2+. Происходит усиление выхода К+ из клеток и снижение входа Са2+. Это ведет к гиперполяризации мембран и снижению их возбудимости.
Нарушения нормального автоматизма. Известно, что в основе автоматизма лежит медленная спонтанная диастолическая деполяризация, постепенно понижающая МП до порогового уровня, с которого начинается быстрая деполяризация мембраны (фаза 0 ПД). На продолжительность спонтанной деполяризации и, следовательно, на частоту сердечной деятельности оказывают влияние следующие механизмы. 1. Скорость спонтанной диастолической деполяризации.При ее возрастании пороговый потенциал возбуждения достигается быстрее и происходит учащение синусового ритма. Замедление спонтанной диастолической деполяризации, ведет к замедлению синусового ритма. 2. Изменение величины мембранного потенциала покоя СА-узла.Когда мембранный потенциал становится более отрицательным (при гиперполяризации клеточной мембраны, например при действии ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если, разумеется, скорость спонтанной диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение частоты сердечных сокращений (ЧСС). При увеличении мембранного потенциала покоя, когда он становится менее отрицательным, частота сердечных сокращений, напротив, возрастает. 3. Изменение порогового потенциала возбуждения. Его уменьшение (более отрицательный) способствует учащению синусового ритма, а увеличение (менее отрицательный) - брадикардии. Величина порогового потенциала возбуждения кардиомиоцитов определяется свойствами Na+- каналов, а клеток проводящей системы – Ca2+- каналов. В связи с этим следует напомнить, что в основе фазы быстрой деполяризации в клетках рабочего миокарда лежит активация быстрых Na+- каналов, а в клетках специализированной ткани сердца - Ca2+- каналов. 4. Различные комбинации 3-х основных электрофизиологических механизмов, регулирующих автоматизм СА-узла. Аномальный автоматизм(эктопический автоматизм)– это появление пейсмекерной активности в клетках сердца, не являющихся водителями сердечного ритма. В норме эктопическая активность подавляется импульсами, поступающими из СА-узла, но при блокаде проведения импульса по предсердиям главным водителем ритма сердца может стать АВ-узел. Способность к спонтанной деполяризации клеток АВ-узла менее выражена, чем в клетках СА-узла, поэтому в условиях поперечной блокады обычно развивается брадикардия. Еще менее выражена способность к автоматизму у волокон Пуркинье. Однако эти волокна, как и другие клетки проводящей системы, более устойчивы к гипоксии, чем сократительные кардиомиоциты, в связи с чем, не всегда погибают в зоне ишемии. Электрофизиологические свойства ишемизированных волокон Пуркинье существенно отличаются от параметров интактных волокон тем, что у них появляется пейсмекерная активность, а способность к проведению импульса существенно снижается. Кроме того, пейсмекерная активность, возникающая в волокнах Пуркинье, в условиях патологии (например, при ишемии) перестает подавляться импульсами, поступающими из СА-узла, и может быть причиной возникновения желудочковых экстрасистол. Нарушение возбудимости Повышение возбудимости кардиомиоцитов наиболее часто обусловливает возникновение аритмий по механизму триггерной(наведенной, пусковой) активности(от англ.trigger – спусковой крючок). В некоторых случаях нормальный потенциал действия (ПД) может вызывать дополнительные деполяризации, что сопровождается увеличением ЧСС. Это явление, называемое постдеполяризацией, наблюдается тогда, когда первый ПД приводит к быстрым колебаниям трансмембранного потенциала кардиомиоцитов. В отличие от спонтанной активности, которая проявляется при усилении автоматизма, эта дополнительная деполяризация вызывается предсуществующим ПД. В зависимости от времени наступления по отношению к возбуждающему ПД различают два типа постдеполяризации: ранняя и поздняя постдеполяризации (рис. 2). В обоих случаях (ранняя, поздняя постдеполяризации), если постдеполяризация достигает величины порогового потенциала, то клетки генерируют дополнительные ПД. Потенциал действия, возникающий во время постдеполяризаций, является самоподдерживающимся, вызывая серии последовательных деполяризаций мембраны, что приводит к возникновению тахикардии.
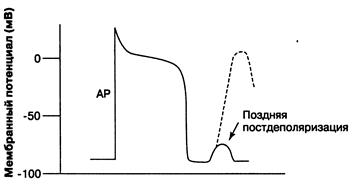 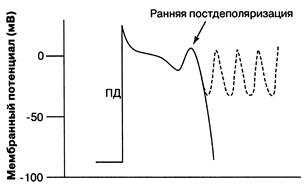
Рис. 2.Триггерная активность. Нарушение проведения импульса
Существует три основных типа нарушений проводимости: 1. замедление и/или блокада проведения импульса; 2. повторный вход импульса (механизм re-entry); 3. сверхнормальное проведение. Замедление и/или блокада проведения электрического импульсапо какому-либо отделу проводящей системы – это форма патологии сердца, патогенетической основой которой могут быть: 1. изменение величины порогового потенциала; 2. изменение величины потенциала действия; 3. изменение скорости деполяризации; 4. изменения структуры проводящей системы. Причины: • усиление вагусных влияний на сердце; • воспалительные и дегенеративные процессы в сердце (ревмокардит, миокардит, ИБС); • интоксикации (алкоголь, бактериальные токсины, передозировка сердечных гликозидов, β-блокаторов); • выраженная гипертрофия желудочков (пороки сердца). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|