|
|
Систолическая функция сердцаФункция возбудимости Функция возбудимости — это способность клеток проводящей системы сердца и сократительного миокарда возбуждаться под влиянием внешних электрических импульсов. Возбуждение сердечной мышцы сопровождается возникновением трансмембранного потенциала действия (ТМПД) — изменяющейся разности потенциалов между наружной и внутренней поверхностями клеточной мембраны. В исходном состоянии наружная поверхность невозбужденной миокардиальной клетки заряжена положительно, а внутренняя — отрицательно (рис. 1.9). Различают несколько фаз ТМПД миокардиальной клетки.
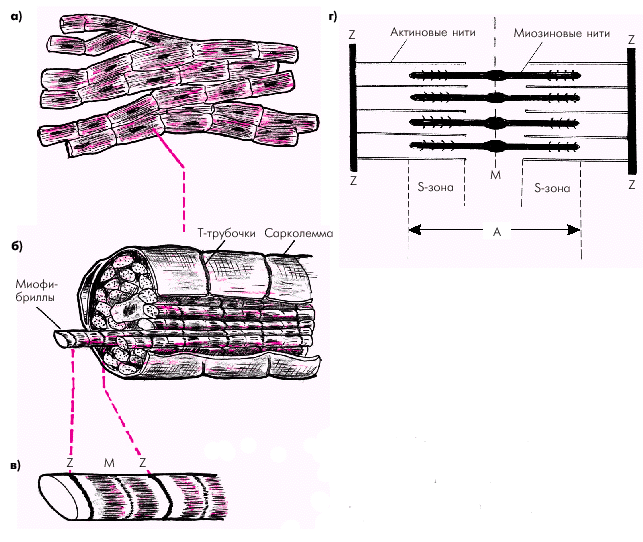
Фаза 0 — во время которой происходит быстрая (в течение 0,01 с) перезарядка клеточной мембраны: внутренняя ее поверхность заряжается положительно, а наружная отрицательно. Фаза 1 — небольшое начальное снижение ТМПД от +20 мV до 0 или чуть ниже (фаза начальной быстрой реполяризации). Фаза 2 — относительно продолжительная (около 0,2 с) фаза плато, во время которой величина ТМПД поддерживается на одном уровне. Фаза 3 (конечной быстрой реполяризации), в течение которой восстанавливается прежняя поляризация клеточной мембраны: наружная ее поверхность заряжается положительно — а внутренняя — отрицательно (–90 мV). Фаза 4 (фаза диастолы). Величина ТМПД сократительной клетки сохраняется примерно на уровне –90 мV. Происходит восстановление исходной концентрации К+, Na+, Ca2+ и Cl–, благодаря работе Na+-К+-насоса. В разные фазы ТМПД возбудимость мышечного волокна различна. В начале ТМПД (фазы 0, 1, 2) клетки полностью не возбудимы (абсолютный рефрактерный период). Во время быстрой конечной реполяризации (фаза 3) возбудимость частично восстанавливается (относительный рефрактерный период). Во время диастолы (фаза 4 ТМПД) рефрактерность отсутствует и миокардиальное волокно полностью возбудимо (рис. 1.9). Функция сократимости Функция сократимости — это способность сердечной мышцы сокращаться в ответ на возбуждение. Этой функцией обладает в основном сократительный миокард. Процесс сокращения запускается ионами Ca2+,входящими в клетку во время ТМПД. Во время реполяризации мембраны происходит удаление ионов кальция из клетки в межклеточную жидкость, в результате чего наступает расслабление мышечного волокна. В результате последовательного сокращения и расслабления различных отделов сердца осуществляется основная — насосная функция сердца. Рассмотрим подробнее процесс сокращения сердечной мышцы. Миокард состоит из множества отдельных поперечнополосатых мышечных клеток — кардиомиоцитов — волокон, торцевые части которых плотно стыкуются друг с другом с помощью так называемых вставочных дисков — нексусов, обладающих очень низким электрическим сопротивлением. Такая структура обеспечивает быстрое распространение волны возбуждения от одной клетки к другой и, соответственно, почти одновременное их сокращение (функциональный синцитий) (рис. 1.10, а). Каждый кардиомиоцит состоит из большого числа переплетающихся между собой нитей миофибрилл, которые тянутся по всей длине мышечного волокна (рис. 1.10, б). Между миофибриллами располагается ядро клетки, митохондрии, а также внутриклеточная система мембран клеток. Окружает миоцит сарколемма, которая образует множество складок и карманов, идущих как в продольном, так и в поперечном направлениях, в том числе — глубоких каналоподобных выпячиваний сарколеммы внутрь клетки (Т-трубочек).
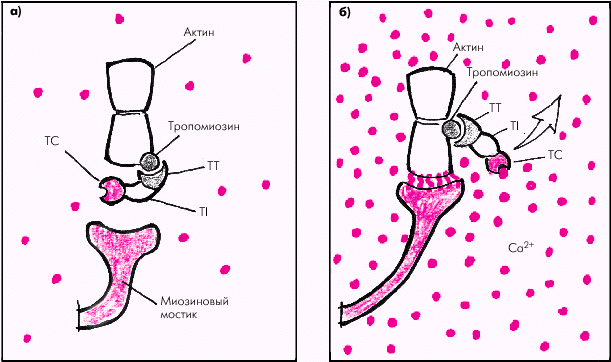
Саркоплазматический ретикулум кардиомиоцитов — это глубокая сеть внутриклеточных канальцев, анастомозирующих между собой и тесно прилегающих к поверхностной мембране (сарколемме) и Т-трубочкам (рис. 1.11). Это обеспечивает быстрое распространение возбуждения сарколеммы и Т-трубочек на мембраны саркоплазматического ретикулума, что сопровождается лавинообразным выходом ионов Са2+ из ретикулума Миофибриллы кардиомиоцитов делятся на периодически повторяющиеся саркомеры, которые представляют собой структурную и функциональную единицу сокращения (см. рис. 1.10, в, г). Каждый саркомер с обеих сторон ограничен темными линиями (так называемыми Z-линиями), тесно связанными с Т-трубочками сарколеммы. Саркомер состоит из тонких нитей (молекул актина) и толстых нитей ( молекул миозина), взаимодействие между которыми лежит в основе сокращения кардиомиоцитов. Толстые нити состоят из длинных молекул миозина, скрученных в спираль и образующих поперечные мостики, выступающие в сторону тонких нитей актина (рис. 1.12). Поперечные мостики содержат миофибриллярную АТФ-азу и обладают способностью образовывать обратимые связи с молекулами актина. Тонкие нити саркомера состоят из двух скрученных в спираль цепей молекул актина, тесно связанных с регуляторными белками — тропомиозином и тропонином (рис. 1.12). Актин способен образовывать соединения с миозином в присутствии АТФ и ионов магния, которые активируют АТФ-азу миозина. Регуляция такого соединения обеспечивается главным образом тропонином С, который обладает высоким сродством к ионам Са2+. Когда мышечное волокно находится в состоянии покоя и тропонин С лишен ионов Са2+, весь тропониновый комплекс приобретает такую конформационную структуру, которая препятствует взаимодействию актина и миозина, и сокращения мышечного волокна не происходит (рис. 1.13, а). Иными словами, тропонин, лишенный ионов Са2+, блокирует взаимодействие актина и миозина.
Во время деполяризации кардиомиоцита в саркоплазматическом ретикулуме происходит лавинообразное высвобождение большого количества ионов Са2+, быстро проникающих в цитоплазму, окружающую саркомеры. При этом ионы Са2+ связываются с тропонином. Это приводит к изменению пространственного расположения всего тропомиозинового комплекса: тропомиозин смещается таким образом, что активные участки тонких спиральных нитей актина становятся доступными для взаимодействия с миозином (рис. 1.13, б).
В результате такого взаимодействия образуются актомиозиновые мостики и актиновые нити скользят вдоль нитей миозина (рис. 1.14), что приводит к укорочению саркомера и всего мышечного волокна или развитию изометрического напряжения. Чем больше ионов Са2+ связалось с тропонином, тем больше образуется актомиозиновых мостиков и тем больше развиваемое мышцей напряжение, т.е. сила сокращения.
Релаксация саркомера и мышечного волокна в целом происходит после того, как ионы Са2+ отщепляются от тропонина, который восстанавливает свою способность блокировать взаимодействие актина и миозина. Этот процесс обеспечивается активным обратным транспортом ионов Са2+ в саркоплазматический ретикулум и внеклеточную среду (рис. 1.15) за счет действия двух механизмов: · кальциевой АТФ-азы мембраны саркоплазматического ретикулума и сарколеммы, которая в присутствии АТФ способствует активному транспорту Са2+ из клетки (рис. 1.15, а); · Nа+-Са2+-обменного механизма клеточной мембраны, в результате которого Nа+ по электрохимическому градиенту перемещается внутрь клетки, а ион Са2+ — во внеклеточное пространство в обмен на ионы Nа+ (рис. 1.15, б). Важно отметить, что функционирование Nа+-Са2+-обменного механизма тесно связано с концентрацией Nа+ внутри и вне клетки, которая достигается благодаря деятельности К+-Nа+-насоса (рис. 1.15, б). Именно этот механизм поддерживает высокие концентрации К+ внутри клетки, и Nа+ — вне клетки. Чем эффективнее работает К+-Nа+-насос, тем меньше внутриклеточная концентрация Nа+ и тем больше ионов Nа+ может проникнуть внутрь клетки по электрохимическому градиенту Nа+, а ионов Са2+ — из клетки в обмен на ионы Nа+. Наоборот, при ингибировании К+-Nа+-насоса (увеличение ЧСС или действие сердечных гликозидов) снижается также интенсивность обменного механизма, и часть ионов Са2+ остается в клетке.
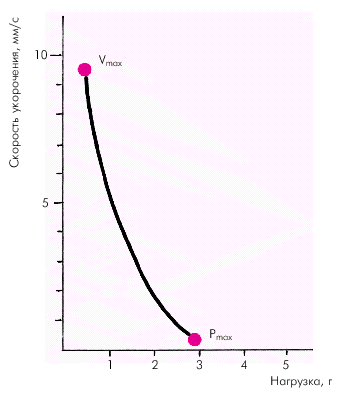
Факторы, определяющие функцию сократимости.Важнейшей характеристикой функционирующей сердечной мышцы является зависимость между скоростью укорочения миокардиального волокна и развиваемым им напряжением (зависимость «сила–скорость»). Согласно данным Hill, скорость сокращения мышцы обратно пропорциональна силе (напряжению). Иными словами, чем больше нагрузка на мышцу, тем меньше скорость ее укорочения. Наоборот, при уменьшении нагрузки скорость сокращения увеличивается (рис. 1.16).
Функция сердечной мышцы, в том числе зависимость «сила–скорость», определяется двумя основными факторами: 1. Исходной длиной мышечного волокна, или конечно-диастолическим объемом желудочка. 2. Состоянием инотропизма (сократимости) миокарда, связанного с интенсивностью обменных процессов в сердечной мышце. Зависимость силы сокращения от исходной длины мышечного волокна является решающим фактором, который определяет функцию сердечной мышцы (E. Braunwald с соавт.). Согласно закону Старлинга увеличение исходного конечно-диастолического объема желудочка в норме приводит к усилению сокращения желудочка, который становится способным развивать большее напряжение и преодолевать большую нагрузку (рис. 1.17). Существенно изменяется при этом и зависимость «сила–скорость» (рис. 1.18, а): увеличение исходной длины мышечного волокна сопровождается возрастанием максимально развиваемой силы сокращения, тогда как максимальная скорость сокращения не меняется. Увеличение инотропизма сердечной мышцы, происходящее под действием возросшей симпатической активности или других факторов (см. ниже), ведет к увеличению как силы, так и максимальной скорости сокращения (рис. 1.18, б). Таким образом, инотропное состояние (сократимость) миокарда характеризуется способностью желудочка без увеличения конечно-диастолического объема (т.е. без «привлечения» механизма Франка–Старлинга) либо 1) выбрасывать в сосудистое русло больший объем крови; либо 2) выбрасывать тот же объем крови против большего сопротивления давления в магистральных сосудах. На рис. 1.17 видно, что при увеличении инотропизма (сократимости) кривая функции желудочка (т.е. взаимосвязи напряжения и конечно-диастолического объема) смещается вверх и влево. Это означает, что при тех же значениях конечно-диастолического объема желудочки в состоянии развивать большее напряжение. При угнетении инотропной функции (снижении сократимости) кривая функции желудочка смещается вправо и вниз. Причем при выраженном падении сократимости кривая идет вначале горизонтально, а затем опускается вниз. Иными словами, при данном состоянии инотропной функции растяжение сердечной мышцы (увеличение конечно-диастолического объема) сопровождается не увеличением, а снижением напряжения миокарда.
Следует еще раз обратить внимание, что состояние инотропизма оказывает влияние и на зависимость «сила — скорость» (рис. 1.18, б): при увеличении инотропизма возрастает не только сила, но и максимальная скорость сокращения, а при снижении сократимости сила и максимальная скорость уменьшаются. | |||||||||||||||||||||||
| |||||||||||||||||||||||
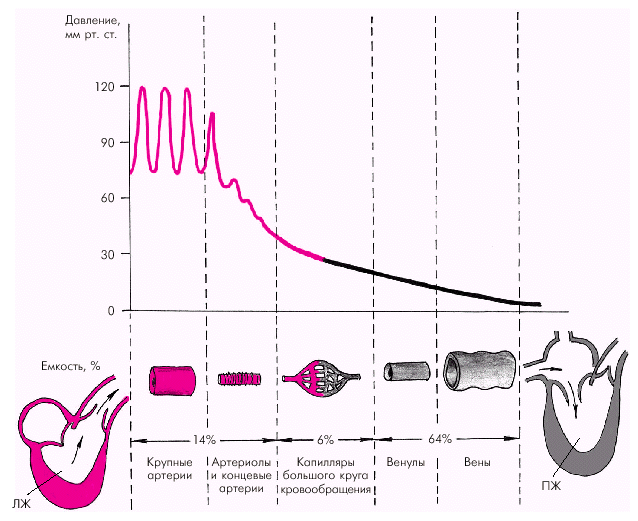
Примерно 84% общего объема крови сосредоточено в большом круге кровообращения; а еще около 16% — в малом круге и сердце. Сосудистая система представлена амортизирующими, резистивными, емкостными сосудами и капиллярами.
К амортизирующим сосудам относятся артерии эластического типа — аорта, легочная артерия и прилегающие к ним участки крупных артерий. Их стенка содержит большое количество эластических волокон, что позволяет амортизировать (сглаживать) значительные колебания артериального давления (АД), обусловленные систолическим выбросом крови в аорту и легочную артерию (эффект компрессионной камеры).
Резистивные сосуды (преимущественно концевые артерии и артериолы) характеризуются относительно малым просветом и толстыми гладкомышечными стенками. На их долю приходится около 50% общего сосудистого сопротивления кровотоку, хотя общая емкость их сравнительно невелика (рис. 1.34).
Уровень АД в концевых артериях и артериолах снижается примерно в 1,5–2 раза по сравнению с давлением в аорте, а пульсирующий кровоток постепенно сменяется непрерывным. В капиллярах, объем которых составляет около 6% объема крови, ток крови равномерный в разные фазы сердечного цикла. Истинные капилляры, т.е. сосуды, стенки которых содержат лишь один слой клеток эндотелия, лишены гладкомышечных элементов. В большинстве случаев они под прямым углом отходят от так называемых метартериол («основных каналов»), которые переходят в венулы (рис. 1.35). В области отхождения капилляров от метартериол имеются прекапиллярные сфинктеры. Именно от их сокращения или расслабления зависит, какая часть крови проходит через истинные капилляры, а какая часть по метартериолам попадает непосредственно в венулы, минуя истинные капилляры. Общий же объем кровотока через метартериолы и капилляры определяется соотношением прекапиллярного и посткапиллярного сопротивления артериол и венул.
Емкостные сосуды (венулы и вены) отличаются низким кровяным давлением. Они являются важнейшими депо крови в организме: даже в нормальных физиологических условиях в них сосредоточено до 64% крови. При патологии емкость венул и вен может увеличиваться еще больше. | |||||||||||||||||||||||
| |||||||||||||||||||||||
Движение крови по сосудам подчиняется законам гемодинамики. Движущей силой кровотока является градиент давления между артериальной и венозной областями сосудистой системы. У взрослого здорового человека кровоток в сосудах носит, главным образом, ламинарный характер, причем центральный осевой поток крови, состоящий в основном из форменных элементов, имеет максимальную скорость, а периферические слои, непосредственно прилежащие к стенке сосуда и состоящие из плазмы, — минимальную скорость (рис. 1.36, а). Турбулентный ток крови в норме возникает в местах разветвлений и естественных сужений и изгибов аорты и крупных артерий (рис. 1.36, б).
Средняя скорость кровотока в различных сосудистых областях зависит от градиента давлений в начале и в конце сосуда и величины сосудистого сопротивления, которое, в свою очередь, определяется вязкостью крови и поперечным сечением сосуда. Чем больше градиент давлений и/или чем меньше вязкость крови и суммарное поперечное сечение сосудов данной области, тем выше линейная скорость кровотока. В аорте она максимальна (50–70 см/с), в артериях и артериолах, суммарный поперечный просвет и сосудистое сопротивление которых во много раз больше, средняя линейная скорость падает (20–40 см/с в аорте и около 0,5 см/с — в артериолах). Наибольшей суммарной площадью просвета обладают капилляры. Здесь скорость движения крови не превышает 0,05 см/с. Общее время прохождения «частиц» крови по большому и малому кругам кровообращения в норме составляет примерно 23 с. Артериальное давление (АД) является важнейшим интегральным показателем функционирующей системы кровообращения. На протяжении сердечного цикла уровень АД постоянно меняется, повышаясь в начале изгнания и снижаясь во время диастолы. В момент сердечного выброса часть крови, находящейся в проксимальном сегменте восходящей аорты, получает значительное ускорение, тогда как остальная часть крови, обладающая инерцией, ускоряется не сразу. Это приводит к кратковременному повышению давления в аорте, стенки которой несколько растягиваются. По мере того как остальная часть крови ускоряет свое движение под влиянием пульсовой волны, давление в аорте начинает падать, но все же в конце систолы остается более высоким, чем в ее начале. Во время диастолы давление равномерно снижается, но АД не падает до нуля, что связано с эластическими свойствами артерий и достаточно высоким периферическим сопротивлением. Таким образом, уровень АД зависит от нескольких факторов: · величины сердечного выброса; · емкости сосудистой (артериальной) системы; · интенсивности оттока крови; · упругого напряжения стенок артериальных сосудов; · объема циркулирующей крови и т.д. Различают систолическое, диастолическое, пульсовое и среднее АД (рис. 1.37). Систолическое АД (САД) — это максимальное давление в артериальной системе, развиваемое во время систолы левого желудочка. Оно обусловлено в основном ударным объемом сердца и эластичностью аорты и крупных артерий. Диастолическое АД (ДАД) — это минимальное давление в артерии во время диастолы сердца. Оно во многом определяется величиной тонуса периферических артериальных сосудов. Пульсовое АД (АДп) — это разность между систолическим и диастолическим АД.
Среднее АД (АДср) — это результирующая всех переменных значений АД на протяжении сердечного цикла, вычисленная путем интегрирования кривой пульсового колебания давления во времени (рис. 1.37, б):
где Р1, …, Рn — переменные значения давлений на протяжении сердечного цикла, n — число измерений давления на протяжении сердечного цикла. В клинике среднее АД для периферических артерий принято вычислять по формуле:
Среднее АД является важнейшей интегральной гемодинамической характеристикой системы кровообращения. Это та средняя величина давления, которая была бы способна при отсутствии пульсовых колебаний давления дать такой же гемодинамический эффект, какой наблюдается при естественном, колеблющемся движении крови в крупных артериях (И.А. Ефимова). | |||||||||||||||||||||||
| |||||||||||||||||||||||
Изменения центральной и региональной гемодинамики, постоянно происходящие в организме под действием разнообразных внешних и внутренних факторов, осуществляются за счет изменений минутного объема (сердечный выброс и ЧСС) и сосудистого сопротивления (просвет кровеносных сосудов, преимущественно артериол).
Местные (периферические) механизмы
Местные механизмы саморегуляции сосудистого тонуса обеспечивают адекватный кровоток в органах в зависимости от уровня метаболизма в них. Периферические механизмы саморегуляции позволяют поддерживать необходимую объемную скорость кровотока в жизненно важных органах (головной мозг, сердце, почки) даже при резком изменении системного АД — его падении или повышении.
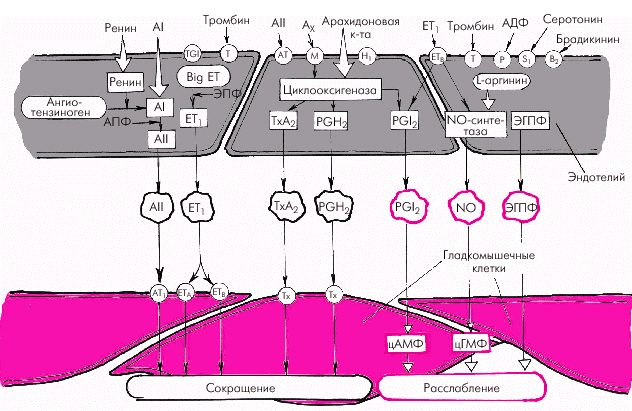
Эндотелиальные факторы Решающее значение в регуляции сосудистого тонуса придается в последние годы так называемым эндотелиальным факторам (рис. 1.38). Было установлено, что сосудистый эндотелий является местом образования целого ряда соединений, участвующих в регуляции сосудистого тонуса, функции тромбоцитов и свертывания крови. В настоящее время выделяют несколько вазодилатирующих и вазоконстрикторных субстанций.
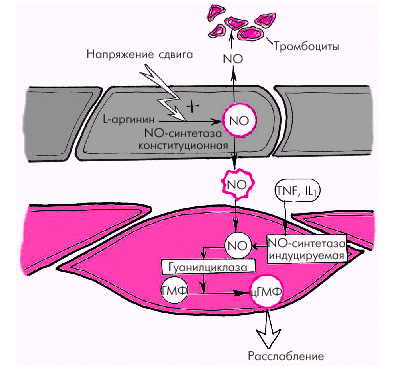
Вазодилатирующие факторы. Основными эндотелийзависимыми вазодилатирующими факторами, оказывающими влияние на сосудистый тонус и агрегацию тромбоцитов, являются эндотелиальный расслабляющий фактор (оксид азота, NO), простациклин PGI2 и эндотелиальный гиперполяризующий фактор (ЭГПФ). 1. Эндотелиальный расслабляющий фактор (оксид азота, NO), обеспечивает выраженную релаксацию гладких мышц артерий, артериол и вен, а также препятствует адгезии и агрегации тромбоцитов. Оксид азота продуцируется сосудистым эндотелием из L-аргинина спонтанно, а также при стимулировании эндотелиальной клетки рядом биологически активных веществ и медиаторов (ацетилхолин, гистамин, брадикинин, субстанция Р и др.), продукция которых возрастает в том числе при физической нагрузке и увеличении работы сердца. Освободившийся из L-аргинина оксид азота (NO) активирует гуанилатциклазу гладкомышечной клетки с образованием цГМФ, что приводит к ее активному расслаблению (рис. 1.39).
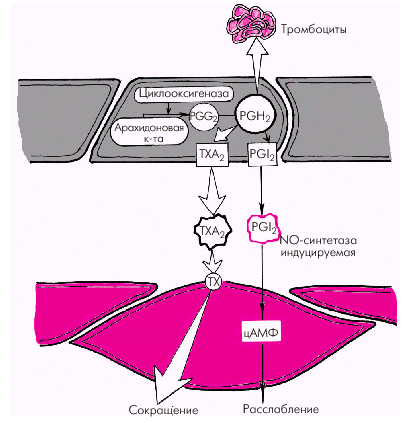
2. Простациклин также относится к числу важнейших вазодилататоров, препятствующих вазоконстрикторному эффекту тромбоксана А2 и агрегации тромбоцитов. Простациклин PGI2 является продуктом метаболизма арахидоновой кислоты, освобождающейся стимулированными тромбоцитами, из которой под действием циклооксигеназы синтезируется либо простациклин PGI2, либо тромбоксан А2 (рис. 1.40). 3. Эндотелиальный гиперполяризующий фактор (ЭГПФ), также вырабатываемый эндотелиальными клетками, вызывает гиперполяризацию мембран гладкомышечных клеток (подробнее — см. главу 3) и снижает их чувствительность к разнообразным констрикторным влияниям. Выделение ЭГПФ вызывает открытие калиевых каналов гладкомышечных клеток, что сопровождается расслаблением сосудов. Характерно, что в отличие от оксида азота, ЭГПФ выделяется эндотелием не постоянно, а только под действием некоторых стимулов (ацетилхолин, брадикинин, тромбин, гистамин, субстанция Р, АДФ, АТФ и др.).
Вазоконстрикторные факторы.К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЕТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. 1. Эндотелин-1 (ЕТ1) является наиболее мощным из всех известных вазоконстрикторов. Процесс образования ЕТ1 включает несколько стадий (рис. 1.41). Вначале из предшественника эндотелинов (препроэндотелина) образуется так называемый «большой эндотелин» (проэндотелин), который, в свою очередь, под действием эндотелин-превращающего фермента (ЭПФ) трансформируется в активный полипептид, состоящий из 21 аминокислоты, — эндотелин-1 (ЕТ1). Связываясь со специфическими рецепторами клеточных мембран (ЕТА и ЕТВ), эндотелин-1 повышает внутриклеточную концентрацию ионов Са2+, что ведет к усилению сокращения гладких мышц сосудистой стенки. В физиологических условиях концентрация ЕТ1 в плазме очень мала, что связано, прежде всего, с ингибированием синтеза эндотелина-1 описанными выше вазодилатирующими субстанциями (оксидом азота и простациклином РGI2). Малые количества ЕТ1 активируют образование эндотелиальными клетками этих факторов расслабления (рис. 1.41, левая часть). В более высоких концентрациях ЕТ1 стимулирует рецепторы ЕТА и ЕТВ гладкомышечных клеток, вызывая стойкую и выраженную вазоконстрикцию (рис. 1.41, правая часть). Образование ЕТ1 усиливается при воздействии на эндотелиальные клетки тромбина, вазопрессина, интерлейкина-1, ангиотензина II и других веществ, а также при возникновении гипоксии, повышении АД, ускорении кровотока и т.п.
2. Тромбоксан А2 и простагландин РGН2 относятся к числу активных эндотелиальных вазоконстрикторов, обладающих также свойством активировать агрегацию тромбоцитов и тромбообразование. Являясь продуктами метаболизма арахидоновой кислоты, они присутствуют во многих тканях организма, в том числе в сосудистом эндотелии (см. рис. 1.38 и 1.40). 3. Тканевой ангиотензин II (АII) также относится к числу мощных вазоконстрикторов, образующихся в эндотелии различных сосудистых областей (см. рис. 1.38). Он образуется из неактивного ангиотензина I (АI) под действием тканевого ангиотензин-превращающего фермента (АПФ). Этот фермент присутствует в эндотелиальных клетках, что обеспечивает образование АII непосредственно на поверхности эндотелия. Взаимодействуя со специфическими ангиотензиновыми рецепторами (АТ1) гладкомышечных клеток, он также увеличивает внутриклеточную концентрацию Са2+, усиливая сокращение гладких мышц сосудистой стенки. В физиологических условиях существует оптимальное соотношение выработки эндотелиальных вазодилатирующих и вазоконстрикторных субстанций, которое полностью соответствует метаболическим потребностям органа и основным параметрам центральной гемодинамики. При действии на сосудистый эндотелий различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и др.) начинают преобладать вазоконстрикторные механизмы регуляции сосудистого тонуса и развивается так называемая дисфункция эндотелия. Последняя характеризуется повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов, процессов пристеночного тромбообразования и т.п.
Продукты метаболизма В интенсивно работающем органе под действием продуктов метаболизма (ионов Н+, аденозина, АТФ, АДФ, АМФ, СО2, молочной кислоты и др.) и биологически активных веществ (брадикинина, гистамина и др.) также происходит снижение тонуса артериол и прекапиллярных сфинктеров и увеличивается, таким образом, число функционирующих капилляров. Наоборот, при снижении метаболизма эти эффекты уменьшаются и происходит адекватное ограничение органного кровотока. Одним из таких продуктов метаболизма является аденозин — вещество, играющее важную роль в распаде макроэргических фосфатных соединений. Доказано, что усиление метаболизма органа (например, сердца) закономерно сопровождается ускоренным дефосфорилированием АМФ с образованием аденозина, который, поступая в межклеточное пространство, вызывает значительное расширение артериол и увеличение органного кровотока. Центральные механизмы регуляции Центральные механизмы регуляции сосудистого тонуса включают в себя афферентное (сенсорное), центральное и эфферентное звенья. Афферентное звено представлено многочисленными баро- и хеморецепторами, расположенными в нескольких рефлексогенных зонах сосудистой системы (аорта, синокаротидная зона, сосуды легких и др.) (рис. 1.42). Барорецепторы реагируют на степень и скорость растяжения стенки сосудов (или полостей сердца). При повышении АД или наполнения камер сердца барорецепторы отвечают усилением афферентной импульсации, при снижении АД — ее уменьшением. Хеморецепторы дуги аорты, синокаротидной зоны и других рефлексогенных зон (сердце, почки, органы пищеварения) аналогично реагируют на изменение в крови концентрации О2, СО2, ионов Н+. Чувствительные волокна от баро- и хеморецепторов дуги аорты и каротидного синуса проходят в составе синокаротидного нерва, ветвей языкоглоточного нерва и депрессорного нерва (рис. 1.42). Центральное звенорегуляции сосудистого тонуса — вазомоторный центр — представлено различными функционально связанными между собой нервными структурами, расположенными в продолговатом, спинном мозге, гипоталамусе, коре больших полушарий. Эфферентное звеновключает нервные и гуморальные механизмы регуляции сосудистого тонуса. В зависимости от скорости развития циркуляторных эффектов различают: 1) механизмы быстрого кратковременного действия; 2) механизмы промежуточного действия; 3) механизмы длительного действия.
К механизмам быстрого кратковременного действия относятся нервные рефелекторные реакции, возникающие при раздражении баро- и хеморецепторов описанных рефлексогенных зон, а также при ишемии ЦНС. Эти реакции развиваются в течение нескольких секунд и реализуются через рефлекторные изменения активности симпатической и парасимпатической нервных систем, а также через изменение концентрации гуморальных веществ — адреналина и норадреналина. Раздражение барорецепторов аорты и каротидного синуса (например, при повышении АД или механическом воздействии на эти зоны) закономерно приводит к снижению симпатических (вазоконстрикторных) и усилению парасимпатических (депрессорных) влияний. В результате снижается сосудистый тонус, а также частота и сила сокращения сердца, что способствует нормализации АД. Наоборот, при падении АД (например, при кровопотере) импульсация с барорецепторов уменьшается и начинают преобладать симпатические влияния — увеличение ЧСС, сердечного выброса и сосудистого тонуса. Аналогичным образом возникает ответ на раздражение В-рецепторов растяжения предсердий и рецепторов растяжения желудочков, например, при быстром увеличении их наполнения. В результате снижения тонуса симпатических и повышения активности парасимпатических нервов развивается брадикардия и вазодилатация. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|





 Запомните
1. В основе периодически сменяющих друг друга состояний мышечного сокращения и расслабления кардиомиоцитов лежит способность клеточных мембран обеспечивать различное движение ионов Са2+ из саркоплазматического ретикулума к миофибриллам (сокращение) и обратно (расслабление). 2. Содержание ионов Са2+ в кардиомиоцитах является главным фактором, регулирующим инотропное состояние сердца. Чем выше внутриклеточная концентрация Са2+, тем больше сократимость миокарда. 3. Внутриклеточная концентрация Са2+ регулируется многими факторами, в том числе активностью Са2+-АТФ-азы, К+-Nа+-насоса и Nа+-Са2+-обменного механизма.
Запомните
1. В основе периодически сменяющих друг друга состояний мышечного сокращения и расслабления кардиомиоцитов лежит способность клеточных мембран обеспечивать различное движение ионов Са2+ из саркоплазматического ретикулума к миофибриллам (сокращение) и обратно (расслабление). 2. Содержание ионов Са2+ в кардиомиоцитах является главным фактором, регулирующим инотропное состояние сердца. Чем выше внутриклеточная концентрация Са2+, тем больше сократимость миокарда. 3. Внутриклеточная концентрация Са2+ регулируется многими факторами, в том числе активностью Са2+-АТФ-азы, К+-Nа+-насоса и Nа+-Са2+-обменного механизма.