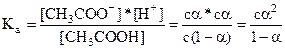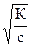|
|
Взаимосвязь константы диссоциации и степени диссоциации.12 Тема 7-8. Протолитические равновесия и процессы. Водородный показатель (рН), гидролиз солей, буферные системы) Электролитическая диссоциация. рН растворов. Электролитами называют вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток. Электролитическая диссоциация – процесс распада веществ на ионы, происходящий вследствие электростатического взаимодействия вещества с полярными молекулами растворителя. Для количественной характеристики процесса электролитической диссоциации используют степень электролитической диссоциации (a). Степенью электролитической диссоциации называется отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита. Значение a в растворах может изменяться в пределах: 0 <a <1 (или 0 <a <100%). На степень электролитической диссоциации влияют следующие факторы: 1. Концентрация раствора. Степень электролитической диссоциации возрастает с уменьшением концентрации раствора, так как это способствует диссоциации электролита. 2. Температура. Процесс электролитической диссоциации обычно эндотермический, поэтому степень диссоциации увеличивается с повышением температуры раствора. Все электролиты по значению a принято делить на сильные и слабые электролиты. Сильными электролитами(a > 0,7) являются сильные кислоты, щелочи и большинство солей. К слабым электролитам (a < 0,1) относятся слабые кислоты и слабые основания (CH3COOH, H2CO3, HCN, NH4 ОН). Очень слабым электролитом является вода. Диссоциация воды. Процесс диссоциации воды протекает по уравнению: Н2О « Н+ + ОН‑ Константа диссоциации воды при 298 К, определенная методом кондуктометрии, равна:
Степень диссоциации воды очень мала (очень слабый электролит), поэтому активность водород- и гидроксид-ионов в чистой воде практически равны их концентрациям. Так как вода присутствует в большом избытке, ее концентрация может считаться постоянной и составляет 55,6 моль/л (1000 г : 18 г/моль = 55,6 моль). Подставляя в выражение для константы диссоциации Кд (Н2О) это значение, а вместо активностей водород- и гидроксид-ионов их концентрации, получают новое выражение: Кw = [ Н+] *[ОН‑] = 10-14 моль2/ л 2 при 298 К Согласно этому выражению, в чистой воде, или любом водном растворе при постоянной температуре, произведение концентраций водород- и гидроксид -ионов есть величина постоянная, называемая ионным произведением воды. Константа Кw зависит от температуры. При повышении температуры Кw увеличивается, так как процесс диссоциации воды - эндотермический. Отрицательный десятичный логарифм концентрации водород-ионов называют водородным показателем или рН среды:рН = - lg [Н+] Реакцию среды можно охарактеризовать и гидроксильным показателем, т.е. отрицательным десятичным логарифмом концентрации гидроксид-ионов: рОН = - lg [ОН-] В нейтральной среде [Н+] =[ОН-] [Н+] =10-7 моль/л, рН =7,0 рОН = 7, В кислой среде [Н+] >[ОН-] [Н+] >10-7 моль/л, рН < 7,0 рОН > 7 В щелочной среде [Н+] < [ОН-] [Н+] < 10-7 моль/л, рН >7,0 рОН < 7, рН + рОН =14 Взаимосвязь константы диссоциации и степени диссоциации. Процесс электролитической диссоциации слабых электролитов характеризуется степенью диссоциации (a) и константой диссоциации (Ка или Кв), а также равновесными концентрациями неионизированного электролита и его ионов:
Полученное уравнение называется «законом разбавления Оствальда». Для растворов слабых электролитов при a < 0,01, т.е. (1 - a) » 1, приведенное выше уравнение приобретает следующий вид: Ка = с a2 и a = Это соотношение показывает, что степень диссоциации слабого электролита при разбавлении раствора увеличивается обратно пропорционально корню квадратному из его молярной концентрации. Жидкие биологические среды содержат сильные электролиты (NaС1, КС1, КН2РO4, NаНСОз), слабые электролиты (Н2СОз, жирные кислоты, окси- и аминокислоты, анионы солей Н2Р04), а также высокомолекулярные соединения - белки, нуклеиновые кислоты- полиэлектролиты. Слюна обладает свойствами электролитов. рН слюны в норме равен 6,9. Величина водородного показателя изменяется в зависимости от характера патологического процесса в полости рта. Так, при инфекционных заболеваниях реакция слюны кислая; при инсульте слюнные железы на стороне кровоизлияния выделяют слюну с повышенным количеством белка. Таким образом, исследование состава слюны можно предпринимать с диагностической целью. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
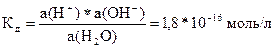 где а(Н+), а(ОН‑), а(Н2О) - активность ионов Н+, ОН‑ и воды.
где а(Н+), а(ОН‑), а(Н2О) - активность ионов Н+, ОН‑ и воды.