
|
|
Равновесие между раствором и осадком малорастворимого сильного электролита. Произведение растворимости. Условия растворения и образования осадков.В случае, когда мы имеем дело с малорастворимым химическим соединением, образующим при растворении электролит, в системе быстро устанавливается равновесие между раствором и осадком, причем растворенная часть малорастворимого соединения практически полностью диссоциирует на ионы. Это понятно, если принять во внимание редкость столкновений частиц, образующихся из растворенного соединения в разбавленных растворах. Поэтому малорастворимые электролиты являются сильными. Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором, описывается уравнением: АаВв(т) Получившееся в правой части произведение равновесных концентраций ионов, на которые диссоциирует в растворе малорастворимый сильный электролит (в степенях, равных стехиометрическим коэффициентам уравнения диссоциации), называется произведением растворимости (ПР) малорастворимого сильного электролита: Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению: К обменным реакциям, протекающим в растворе электролитов, относятся реакции осаждения и растворения. Реакции осаждения сопровождаются выпадением осадков. Реакции, сопровождающиеся растворением осадков, называются реакциями растворения. Широко используют системы, состоящие из осадка труднорастворимого электролита и насыщенного раствора над ним. В таких системах между насыщенным раствором и осадком устанавливается динамическое равновесие. Вследствие низкой растворимости концентрация труднорастворимого электролита в растворе очень мала, поэтому можно считать, что в растворе он полностью диссоциирован. Иначе говоря, динамическое равновесие в насыщенном растворе устанавливается между твердой фазой вещества и перешедшими в раствор ионами. Например, в насыщенном растворе AgCl имеет место равновесие: AgCl(T) > Ag+(p) + Cl-(р). Концентрация твердой фазы AgCl как величина постоянная из выражения для константы равновесия исключается. Вследствие этого константа равновесия определяется только произведением концентраций ионов в растворе и называется константой или произведением растворимости. В общем случае для электролита Ktn Anm константа растворимости определяется стехиометрическим произведением концентраций ионов: Кпр= [Ktm+ ]n[Ann–]m Эта величина характеризует растворимость электролита при постоянной температуре в отсутствие посторонних веществ. Постоянство Кпр не означает постоянства концентраций отдельных ионов в растворе. Так, можно увеличить концентрацию ионов Ag в насыщенном растворе AgCl, добавив, например, AgNO3 , при этом равновесие по принципу Ле Шателье сместится влево, что приведет к увеличению скорости осаждения ионов. Через некоторое время скорости растворения AgCl и осаждения ионов Ag и Cl сравняются. Вновь установившееся равновесие будет, как и прежде, характеризоваться величиной Кпр(AgCl), но равновесные концентрации ионов Ag и Cl изменятся. Таким образом, на основе Кпр можно прогнозировать образование и растворение осадков электролитов на основе двух правил. 1. Электролит выпадает в осадок, когда стехиометрическое произведение концентраций его ионов в растворе больше константы растворимости. 2. Осадок электролита растворяется, когда стехиометрическое произведение концентраций составляющих его ионов в растворе становится меньше константы растворимости. Реакции осаждения лежат в основе метода осаждения, который применяется в количественном анализе фармацевтических препаратов. Метод осаждения используется в клиническом анализе хлоридов в моче, желудочном соке, крови, в санитарно-гигиенической практике – при анализе питьевой воды. Ученые считают, что различная растворимость природных соединений элементов в воде оказала большое влияние на их содержание в живых организмах. Между растворимостью соединений в воде и токсическим действием ионов ряда элементов имеется тесная взаимосвязь. Например, введение Al3 + в организм вследствие образования малорастворимого фосфата алюминия AlPO4. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
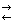 АаВв(р)
АаВв(р) 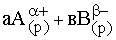 .
.