
|
|
Методика анализов водного раствора гидроксида натрияХЕМОСОРБЦИЯ ДИОКСИДА УГЛЕРОДА ГИДРОКСИДОМ НАТРИЯ. ИОННО ОБМЕННЫЙ СПОСОБ ОЧИСТКИ ВОДЫ.
ЛАБОЛАТОРНАЯ РАБОТА №5
Хемосорбция диоксида углерода гидроксидом натрия 1. Общие сведения Хемосорбционными называются гетерогенные процессы взаимодействия газа с жидкостью, в которых физическая абсорбция газа сопровождается реакцией в жидкой фазе. Хемосорбционные процессы широко распространены в промышленности. В зависимости от соотношения скоростей реакции и абсорбции хемосорбционные процессы могут протекать в кинетической , диффузионной и промежуточной областях.
При протекании хемосорбции в кинетической области скорость хемосорбции лимитируется (тормозиться) реакцией, и для интенсификации процесса необходимо повышать температуру, использовать катализаторы, увеличивать относительный объем жидкой фазы. В случае диффузионной области для ускорения хемосорбции целесообразно увеличивать межфазную поверхность (диспергировать газ или жидкость) ,усиливать перемешивание жидкой или газовой фазы, увеличивать относительную скорость контактирующих потоков. При протекании процесса В промежуточной области целесообразно использовать факторы, ускоряющие как реакцию, так и массообмен. При хемосорбции диоксида углерода из смеси с воздухом водным раствором гидроксида натрия в жидкой фазе протекает реакция . Указанная реакция позволяет наглядно познакомиться с хемосорбционными процессами и исследовать некоторые влияния некоторых факторов на их протекание.
Цель работы
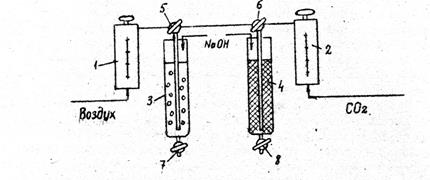
1.Исследоват влияние технологического режима на скорость хемосорбции; 2.Рассчитать показатели работы хемосорбционного колонного реактора. 3. Описание лабораторной установки Скорость подачи воздуха устанавливается с помощью ротометра 1, а скорость подачи диоксида углерода – с помощью ротаметра 2 с использованием градуировочных графиков (рис.3.1) Стр 4.
Смесь диоксида углерода с воздухом может подаваться или и в барботажную колонну 3, или в насадочную колонну 4 с помощью трехходовых кранов 5 и 6. Слив или отбор на анализ реакционной смеси производится с помощью кранов 7 и 8 . Рис…
Рис. 3.1. Схема лабораторной установки хемосорбции диоксида углерода гидрогидроксидом натрия: 1- ротаметр для установки расхода воздуха; 2- ротаметр для установки расхода диоксида углерода ; 3- барботажная хемосорбционная колонна ; 4- насадочная хемосорбционная колонна ; 5,6, -трехходовые краны; 7,8,- двухходовые краны. Порядок проведения работы 1.Проанализировать исходный водный раствор на содержание гидроксида натрия; 2. Залить заданный объем водного раствора гидроксида натрия в соответствующую хемосорбционную колонну; 3. Cоединить расходные линии ротамеров с соответствующей хемосорбционной колонной с помощью трехходовых кранов 5 и6 ; 4. Рассчитать объемные расходы диоксида углерода и воздуха, быстро установить расходы с помощью вентилей ротаметров 1 и 2, заметить время начала процесса хемосорбции; 5. Поддерживая установленные расходы газов, проводить хемосорбцию в течение заданного времени. Опредилить объем реакционной зоны по уровню жидкости в хемосорбционной колонне; 6. Прекратить подачу газов по истечении заданного времени с помощью ротаметров 1 и 2
Cтр5
7. Слить реакционную смесь из соответствующей хемосорбционной колонны в приемную колбу с помощью кранов 7 и в и провести ее анализ на содержание гидроксида натрия.
Задание на выполнение работы Преподавателем задаются следующие исходные данные:
1.Тип хетосорбционной колонны (барботажная , насадочная ) 2.Исходный объем водного раствора гидроксида натрия 3.Объемная скорость газовой смеси 4.Объемная доля диоксида углерода в газовой смеси m; 5.Продолжительноть процесса хемосорбции методика анализов водного раствора гидроксида натрия В колбу для титрования наливают 20 см Концентрацию NaОН в анализируемой смеси рассчитывают по формуле 6.1 :
Где .
К
Расчетная часть Степень превращения гидроксида натрия (%): Х Где .
Стр 6 7.2 Степень превращения диоксида углерода (%):
Где
Объем прореагировавшего диоксида углерода за время хемосорбции в рабочих условиях определяется из условия взаимодействия с гидроксидом натрия по формуле
Где V V дм
Где Т раб - температура реакционной смеси ( принимается равной температуре окружающей среды), Р раб - давление окружающей среды, Ра. Объем поданного диоксида углерода определяется по формуле
Где
m - объемная доля диоксида углерода ;
7.3 Производительность хемосорбционной колонны по СО
7.4 Удельная производительность (интенсивность) хемосорбционной колонны J , моль /(ч дм) ; J= Где
Стр 7
7.5 Скорость хемосорбции W ,моль / (ч дм
Исходные, экспериментальные данные и результаты расчетов в формы Форма 7.1. Исходные данные
Форма 7.2. Данные анализов водного раствора гидроксида натрия
Стр.8.
Форма 7.3 Показатели работы хемосорбционных колонн
8 . Меры безопасного ведения работы
8.1 Токсические , пожаро - и взрывоопасные свойства исходных веществ, полупродуктов и продуктов. Водный раствор гидроксида натрия и диоксида углерода не являются взрыво- или пажароопасными. Токсические свойства водного раствора гидроксида натрия могут проявиться только при попадании внутрь организма. Диоксид углерода обладает наркотическими действием, раздражает кожу и слизистые оболочки. При остром отравлении вызывает головную боль, учащение сердце биения, рвоту, повышения кровяного давления.
8.2 Правила безопасного проведения работы 1. Перед началом работы ознакомиться с заданием ,устройством установки, методиками анализов; 2. Пуск установки проводить только с разрешения лаборанта или преподавателя. Если при открывании вентилей ротаметров поплавки не поднимаются, вентили немедленно завернуть. Повторную подачу газов производить только после проверки правильности установки пробок трехходовых кранов 5 и 6 (рис 3.1 ) . Пробы для анализов отбирать пипеткой с грушей. 9. Содержание отчета
1. Теоретическая часть . Краткое изложение понятий о хемосорбции и областях ее протекания
2. Экспериментальная часть. 2.1 Цель работы 2.2 Задание на выполнение работы по форме 7.1 2.3 Схема лабораторной установки 2.4 Порядок выполнения работы Краткое перечисление основных этапов выполнения работы 3. Расчетная часть 3.1 Данные анализов водного раствора гидроксида натрия по форме 7.2 3.2 Показатели работы хемосорбционных колонн по форме 7.3. Таблицы сопровождаются примерами расчетов с приведением расчетных формул с расшифровкой буквенных обозначений и указанием размерностей. 4. Заключение Привести выводы по работе , содержащие анализ влияния технологического режима на показатели работы хемосорбционных колонн.
Список использованных источников ……
ЛАБОРАТОРНАЯ РАБОТА № 6
ИОННОБМЕННЫЙ СПОСОБ ОЧИСТКИ ВОДЫ
1Общие сведения Химическая промышленность использует воду в огромных количествах и для самых разнообразных целей. Перед использованием природная вода из водоемов подвергается очистке от различных примесей: взвешенных частиц (песок , глина), растворенных газов (кислорода, диоксида углерода, окислов азота) и солей (сульфатов, хлоридов, бикарбонатов кальция, магния, натрия, калия и др.). Промышленные водные стоки могут содержать вредные примеси, от которых вода должна быть очищена перед сбрасыванием в водоем. Ионнообменные способы используются для очистки воды от растворенных веществ, которые в воде могут диссоциировать на ионы (кислоты, щелочи, соли). Ионообменный способ очистки воды основан на фильтровании воды с диссоциированными примесями через слой зернистых ионообменников , способных обменивать свои ионы на ионы, содержащиеся в воде. Катиониты - сложные комплексы (сульфоуголь, высокомолекулярные смолы) с подвижными ионами Н Аниониты – высокомолекулярные вещества, содержащие анионы
Важными определениями очистки воды являются ее умягчение и обессоливание. Умягчение воды заключается в выделении из нее ионов Сa и др . придают воде жесткость. Необходимость умягчения воды связана с выпадением в определенных условиях ионов жесткости в виде трудно растворимых осадков на обогреваемых поверхностях аппаратов (теплообменники, рубашки реакторов, паровые котлы). Эти осадки уменьшают свободное сечение трубопроводов, снижают коэффициент теплопередачи, а в паровых котлах, обогреваемым открытым пламенем, могут привести к прожогу стенок с последующим взрывом.
Стр 11
Различают временную (карбонатную), постоянную (карбонатную) общую жесткость. Временная жесткость обусловлена присутствием в воде карбонатов калия и магния Сa 2Mg Постоянная жесткость обусловлена содержанием в воде других (кроме карбонатных) водорастворимых солей кальция и магния CaCl Общая жесткость- сумма временной и постоянной жесткостей. Жесткость воды выражается суммой миллиграмм-эквивалентов ионов Ca Для умягчения воды используют H При этом протекают следующие реакции:
Ca(HCO
MgCl
CaSO
MgCl
Аналогично из воды могут быть извлечены ионы других металлов. С течением времени в связи с обратимостью реакций ионообмена ионы жесткости начинают проскакивать через катионитный фильтр, и жесткость умягчаемой воды постепенно вырастает. При достижении предельно допустимой жесткости Ж Процесс умягчения протекают, и катионит подвергают регенерации. Регенерация в зависимости от требуемого иона осуществляется 2-5 % -ными растворами щелочей, кислот или солей:
Са Мg Ca
Выделившиеся при регенерации вещества вымывают из катионита умягченной или обессоленной водой.
Стр12
Способность катионита обменивать ионы оценивается обменной емкостью катионита. Рабочая обменная емкость катионита Е
Е
Где Ж - жесткость исходной воды, мг-экв/дм Ж
Обессоливание воды заключается в выведении из нее всех катионов и анионов растворенных солей. Обессоливание воды методом ионного обмена заключается в последовательном пропускании воды через H
При этом на катионе обмениваются все катионы солей на ион Н Na
[Aн] Выделившиеся при регенерации анионита кислоты вымывают обессоленной водой. Способность анионита обменивать анионы оценивается обменной емкостью анионита . Например, рабочая обменная емкость анионита Е Е
Где К- концентрация НСl в воде, поступаемой на К
Cтр 13
Цель работы
1. Экспериментально изучить процессы умягчения и обеспечения воды на ионообменниках. 2. Определить рабочие обменные емкости катионита и анионита.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 C
C 
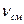 ,
, 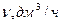 .
. , мин.
, мин. дистиллированной воды и с помощью пипетки с грушей отбирают пробу 1 см
дистиллированной воды и с помощью пипетки с грушей отбирают пробу 1 см  (6.1)
(6.1)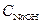 .- концентрация .
.- концентрация .  . в реакционной смеси, моль/дм
. в реакционной смеси, моль/дм 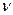
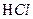 - количество соляной кислоты, пошедшей на титрование пробы, см
- количество соляной кислоты, пошедшей на титрование пробы, см  - поправочный коэффициент концентрации раствора соляной кислоты (указан на склянке с кислотой);
- поправочный коэффициент концентрации раствора соляной кислоты (указан на склянке с кислотой);
 - концентрация гидроксида натрия в исходной смеси, моль/дм.
- концентрация гидроксида натрия в исходной смеси, моль/дм. 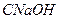 . –концентрация гидроксида натрия в реакционной смеси, моль/дм
. –концентрация гидроксида натрия в реакционной смеси, моль/дм 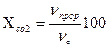
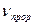 . - объем прореагировавшего диоксида углерода за время хемосорбции в рабочих условиях ,дм
. - объем прореагировавшего диоксида углерода за время хемосорбции в рабочих условиях ,дм 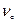 . – объем поданного диоксида углерода за время хемосорбции в рабочих условиях, дм
. – объем поданного диоксида углерода за время хемосорбции в рабочих условиях, дм  ,
, .
.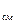
 - объем жидкой реакционной смеси, дм
- объем жидкой реакционной смеси, дм  - объем одного моля диоксида углерода в рабочих условиях ,
- объем одного моля диоксида углерода в рабочих условиях ,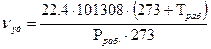
 С ;
С ;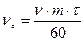
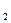 ., моль /ч;
., моль /ч;
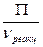
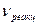 - объем реакционной зоны (с учетом части объема реакционной смеси, занятой газом ) , дм.
- объем реакционной зоны (с учетом части объема реакционной смеси, занятой газом ) , дм. 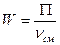
 , моль/ч
4. удельная производительность хемосорбционной колонны по СО
, моль/ч
4. удельная производительность хемосорбционной колонны по СО  )
5. Скорость хемосорбции в расчете на жидкую фазу по СО
)
5. Скорость хемосорбции в расчете на жидкую фазу по СО  , Na
, Na 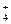 , способные их обменивать на катионы, содержащиеся в воде . Соответственно катионы обозначаются Н
, способные их обменивать на катионы, содержащиеся в воде . Соответственно катионы обозначаются Н 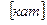 , К
, К  , NН
, NН 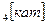 .
.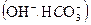 , способные их обменивать на ионы, содержащиеся в воде. Аниониты - высокомолекулярные вещества, содержащие анионы
, способные их обменивать на ионы, содержащиеся в воде. Аниониты - высокомолекулярные вещества, содержащие анионы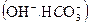 ,. способные их обменивать на ионы, содержащиеся в воде. Аниониты обозначаются
,. способные их обменивать на ионы, содержащиеся в воде. Аниониты обозначаются  ,
, 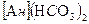
 , Mg
, Mg  .Cl
.Cl  , SO
, SO 
 , Mg
, Mg  ,которые при нагревании переходят в нерастворимые карбонаты
,которые при нагревании переходят в нерастворимые карбонаты
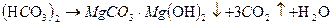
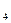 . и пр. Эти соли остаются в воде после кипячения используются другие методы.
. и пр. Эти соли остаются в воде после кипячения используются другие методы.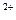 .и Mg
.и Mg 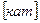 или Na
или Na 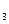 )
)  Ca
Ca 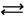 Mg
Mg 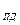 = 0,4 -0,5 мг-экв/дм
= 0,4 -0,5 мг-экв/дм 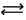 Na
Na  H
H  , мг-экв /дм
, мг-экв /дм 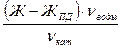
 ;
;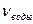 - объем катионита, дм
- объем катионита, дм  ,Ca, Mg(HCO
,Ca, Mg(HCO 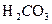 +2НСl+
+2НСl+ 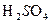
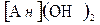
 , Cl
, Cl  моль/дм
моль/дм 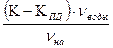 (1.2)
(1.2)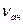 - объем анионита, дм
- объем анионита, дм