
|
|
Кинетика химических процессовХИМИЯ
Сборник индивидуальных домашних заданий для студентов технических направлений дневной формы обучения
c исправлениями
НОВОСИБИРСК УДК 54(07) Х 465
Составители: А.И. Апарнев,канд.хим. наук, доцент В.К. Варенцов, д-р техн. наук, профессор Г.К. Лупенко, канд.хим. наук, доцент Р.Е. Синчурина, ассистент
Рецензент Т.П. Александрова, канд.хим. наук, доцент
Работа подготовлена на кафедре химии
Ó Новосибирский государственный
ОГЛАВЛЕНИЕ
Тема 1. Химический эквивалент. Закон эквивалентов. Окислительно-восстановительные реакции 5 Тема 2. Строение вещества .............................................................................................. 7 Тема 3. Основные закономерности протекания химических процессов............. 8 Тема 4. Кинетика химических процессов и химическое равновесие ................... 9 Тема 5. Растворы электролитов ................................................................................... 12 Тема 6. Коллоидные растворы...................................................................................... 16 Тема 7. Общие свойства растворов ............................................................................. 19 Тема 8. Комплексные соединения................................................................................ 21 Тема 9. Электрохимические процессы ....................................................................... 22 Литература ........................................................................................................................ 28 Приложения........................................................................................................................ 29
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам: Коровин Н.В. Общая химия: учебник для вузов / В.Н. Коровин. – М.: Высшая школа, 2008; Глинка Н.Л. Общая химия: [учебное пособие для вузов] / Н.Л. Глинка; под ред. А.И. Ермакова. – М.: Интеграл-Пресс, 2005, а также и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради (или на отдельных листах) и сдаются преподавателю в сроки, указанные в учебном плане.
Тема 1
Химический эквивалент Закон эквивалентов Окислительно-восстановительные
Задание 1. Даны массы двухвалентного металла (mМе), его оксида (mо) и сульфида (mс) (см. ваш вариант в табл. 1). Таблица 1
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. Установите и запишите химические формулы веществ. Задание 2. Даны масса двухвалентного металла (mМе) и объем кислорода Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл. Задание 3.Дана схема реакции (см. в табл. 2): 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции;
Таблица 2
2) составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления; 3) запишите множители в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты; 4) подберите стехиометрические коэффициенты остальных участников реакции; 5) выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Тема 2 Строение вещества
Задание. Для подчеркнутого элемента, атом которого образует молекулу (см. вариант в табл. 3): 1) напишите электронные формулы, подчеркните валентные электроны и определите семейство; 2) распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях; 3) укажите значения квантовых чисел для валентных электронов; 4) объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
Таблица 3
5) определите степени окисления элементов в молекуле; 6) составьте электронные формулы для атома подчеркнутого элемента с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства. Тема 3 (задание РГР – I этап)
Основные закономерности Задание. Дано уравнение реакции (см. вариант в табл. 4). 1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 2. Вычислите изменение энтальпии реакции 3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 5. Определите температуру, при которой реакция находится в равновесии (Тр). 6. Рассчитайте 7. Постройте график зависимости 8. Вычислите значения константы равновесия Kc при температурах Тр, Т1 и Т2. Cделайте вывод о влиянии температуры на величину Kc и на смещение химического равновесия. Тема 4
Кинетика химических процессов И химическое равновесие
Задание 1.Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой 2. Рассчитайте скорость прямой реакции 3. Рассчитайте увеличение скорости прямой реакции Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4). 1. Запишите выражение для константы равновесия 2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия. 3. Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V и Т). Таблица 4
Окончание табл. 4
Тема 5
Растворы электролитов
Задание 1.Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5). Определите молярную концентрацию вещества (С), молярную концентрацию эквивалентов вещества (Сэк), массовую долю растворенного вещества (ω, %) в растворе и титр раствора (Т).
Таблица 5
Задание 2.Сколько миллилитров раствора А с заданной массовой долей w (%) и плотностью r (г/мл) потребуется для нейтрализации раствора В, содержащего определенную массу т растворенного вещества (см. табл. 6).
Таблица 6
Задание 3. Имеется раствор слабого электролита (см. табл. 7). 1. Запишите уравнения диссоциации и выражения для констант диссоциации (Kд) по всем возможным ступеням, укажите их величины 2. Рассчитайте степень диссоциации слабого электролита, концентрацию ионов H+ в растворе и рН данного раствора с заданной концентрацией электролита. Задание 4.Имеется насыщенный раствор труднорастворимого электролита (см. вариант в табл. 7). Вычислите растворимость данного электролита (в моль/л и г/л) в одном литре воды, используя значение произведения растворимости (см. приложение 3). Задание 5. Имеется раствор соли (см. вариант в табл. 7). 1. Напишите молекулярное и ионно-молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по I ступени (KгI). 2. Рассчитайте степень гидролиза (aг) и рН раствора соли с заданной концентрацией, учитывая только 1-ю ступень гидролиза. 3. Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли? 4. Как изменяться рН раствора соли и окраска индикатора при нагревании и почему?
Таблица 7
Окончание табл. 7
Тема 6 (задание РГР – II этап) Коллоидные растворы
Задание. Даны растворы двух реагентов (см. вариант в табл. 8). 1. Напишите молекулярное уравнение химической реакции образования коллоидной частицы при смешивании двух растворов. 2. Определите, какой реагент взят в избытке. 3. Составьте формулу мицеллы, обозначьте и назовите ее составные части. 4. Определите заряд коллоидной частицы и укажите, к какому электроду будут перемещаться частицы золя в постоянном электрическом поле. 5. Какой из указанных электролитов будет обладать наилучшим коагулирующим действием. Объясните, почему? Таблица 8
Окончание табл. 8
Тема 7 (задание РГР – II этап) Общие свойства растворов
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в табл. 9. Температуры кипения, кристаллизации, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Таблица 9
Окончание табл. 9
Тема 8
Комплексные соединения
Задание 1. Дано комплексное соединение (см. вариант в табл. 10). 1. Укажите: а) внутреннюю и внешнюю сферы, их заряды; б) комплексообразователь, его координационное число и заряд; в) лиганды и их заряд. 2. Для иона комплексообразователя напишите электронную формулу/ 3. Напишите уравнения диссоциации комплексного соединения в водном растворе и выражение константы нестойкости комплексного иона.
Таблица 10
Задание 2.Дано комплексное соединение (см. вариант в табл. 11). 1. Запишите первичную и вторичную диссоциацию комплексного соединения в водном растворе, выражение константы нестойкости комплексного иона и ее численное значение (см. приложение 5). 2. Вычислите концентрации ионов комплексообразователя, лигандов и ионов внешней сферы в растворе комплексной соли с заданной концентрацией (С). Численные значения констант нестойкости комплексных ионов приведены в приложении 5.
Таблица 11 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 технический университет, 2012
технический университет, 2012
 ,
л
,
л
 затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
затраченного на его окисление при н.у. (см. ваш вариант в табл. 1). и
и  .
. и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции. и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции. при Т1 = Тр–100, Т2 = Тр+100.
при Т1 = Тр–100, Т2 = Тр+100. и обратной
и обратной  реакций. Гомо- или гетерогенной является данная реакция?
реакций. Гомо- или гетерогенной является данная реакция? в начальный момент времени (при С0). Как изменится скорость прямой реакции к моменту времени
в начальный момент времени (при С0). Как изменится скорость прямой реакции к моменту времени 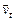 , когда прореагирует 20 % вещества В?
, когда прореагирует 20 % вещества В? при одновременном повышении давления в системе в 2 раза и температуры
при одновременном повышении давления в системе в 2 раза и температуры  на 20 °С при g = 2.
на 20 °С при g = 2. химической реакции через концентрации.
химической реакции через концентрации. 5
5
 19
19
 7
7
 21
21