
|
|
ВОПРОС 2. Основные законы стехиометрии.
Стехиометрия - раздел химии, рассматривающий количественные (массовые, объемные) соотношения между реагирующими веществами. А) закон сохранения массы и энергии. Несмотря на то, что еще в 1760 году Ломоносов по существу сформулировал единый закон массы и энергии, до начала ХХ века эти законы рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы, а физика – с законом сохранения энергии. В 1905 году основоположник современной физики Альберт Эйнштейн показал, что между массой и энергией существует взаимосвязь, количественно выражаемая удивительным по простоте уравнением
Е = m ∙ с2 где: Е — энергия m — масса с — скорость света в вакууме ( 3 ∙ 108 м/сек.) Каждое химическое уравнение символизирует собой закон сохранения массы и энергии, который в уточненной формулировке гласит: Суммарные массы и энергии веществ, вступающие в реакцию, всегда равны суммарным массам и энергиям продуктов реакции. С позиций атомной теории этот закон вполне понятен. При химической реакции количествоатомов до и после реакции остается одинаковым. Это видно из следующего примера:
NaOH + HCl = NaCl + H2O Однако практически все химические реакции сопровождаются тепловыми эффектами. Реакции, которые идут с выделением теплоты, называются экзотермическими, а с поглощением тепла - эндотермическими. При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты. Правильнее эту реакцию записать
NaOH + HCl = NaCl + H2O + 57,53 кДж откуда видно противоречие закону сохранения массы. По уравнению Эйнштейна, если при реакции выделяется энергия, то масса продуктов реакции должна быть меньше массы исходных веществ на величину, эквивалентную выделившейся энергии. Вычислим это уменьшение для реакции E 57,53 ∙ 103 m = — = ————— = 6,39∙ 10-13 кг c2 (3 ∙ 108)2 Ввиду исключительно большой величины квадрата скорости света в вакууме очень малые изменения массы ведут к колоссальному изменению энергии. Таким образом, при химических реакциях, поскольку они сопровождаются энергетическими эффектами, в действительности происходит изменение массы. Однако эти изменения настолько малы, что ими можно пренебречь. Ощутимые же изменения массы наблюдаются в ядерной химии и энергетике, где энергетические эффекты измеряются миллиардами килоджоулей.
б) закон постоянства состава. Закон постоянства состава, сформулированный в 1808г. Ж.Прустом, гласит: Всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав. В качестве примера рассмотрим состав воды: качественный ее состав- она состоит из кислорода и водорода, количественный состав – 88,89% и 11,11%,соответственно. Она имеет выше приведенный состав независимо от того, как она получена: синтезом из водорода и кислорода, реакцией нейтрализации или из кристаллогидратов.
Оксид углерода (II) СО содержит - 42,88% (масс) С 57,12% (масс) О Оксид углерода(IV) СО2 содержит - 27,29% (масс) С 72,71% (масс) О Однако постоянный и неизменный химический состав наблюдается только для молекул (NH3 , SO2), а также кристаллов с молекулярной структурой. Состав соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения. Закон постоянства состава не применим к жидким и твердым растворам (Н2О и NаCl – раствор). Вещества постоянного состава называются дальтонидами(в честь Дальтона), а переменного состава – бертоллидами (в память Бертолле). Состав дальтонидов выражается формулами с целочисленными стехиометрическими индексами (HCl, CH4, Н2О), а бертоллиды – с дробными стехиометрическими индексами. Оксид ванадия (II) может иметь, в зависимости от условий получения, состав от VO0,9 до VO1,3. Бертоллиды встречаются среди бинарных соединений оксидов, гидридов, сульфидов, нитридов, карбидов, силицидов и других неорганических веществ, имеющих кристаллическую структуру. К бертоллидам относится оксид железа II, состав его изображен формулой Fе1-хО, х < 1, т.е. в зависимости от условий можно получить оксиды железа состава Fе0,93О или Fе0,89О. Как вытекает из закона постоянства состава, элементы взаимодействуют между собой в строго определенных количественных соотношениях. В этом случае можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
В) закон кратных отношений Закон кратных отношений установлен 1803 году Джоном Дальтоном. Если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа. На примере оксидов азота – их 5 Масса кислорода на 1г азота Отношение массы кислорода, приходящейся на 1г азота к 0,5714 (N2O)
N2O (1∙ 16): (2∙ 14) = 0, 5714 N O (1∙ 16): (1∙ 14) = 1,428 N2O3 (3∙ 16): (2∙ 14) = 1,7143 NO2 (2∙ 16): (1∙ 14) = 2,2857 N2O5 (5 16): (2∙ 14) = 2,8571 Или на примере оксидов серы: Ar(S) = 32 Ar(O) = 16 1) SO2 m(S) : m(O) = 32 : 32 = 1 : 1 2) SO3 m(S) : m(O) = 32: 48 = 2 : 3
Г) закон эквивалентов Одновременно с законом кратных отношений был сформулирован закон эквивалентов. Эквивалент - это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному катиону водорода или в ОВР одному электрону. Фактор эквивалентности ƒэкв.(х) или 1/Z число, равное той доле частице Х, которая является эквивалентом вещества в данной реакции.( ƒэкв ≤ 1) ƒэкв рассчитывают на основании стехиометрических коэффициентов реакции. Например: (1) H2S + 2Na OH = Na2S +H2O ƒэкв (H2S) =1/2 В этом случае одному катиону H+ эквивалентна условная частица, равная 1/2 молекулы H2S (участвуют оба иона водорода каждой молекулы). (2) H2S + Na OH = NaHS +H2O ƒэкв.(H2S) =1 Одному иону H+ эквивалентна реальная частица – молекула H2 S (в молекуле H2S замещается только один катион водорода). Количество моль - эквивалентов измеряется в молях, как любое количество вещества. Масса 1 моль эквивалента, молярная масса эквивалента, равна произведению фактора эквивалентности на молярную массу вещества
M(ƒэкв (х) х) = ƒэкв (х) ∙ М(х) Так, молярная масса эквивалента иона алюминия М(1/3Аl+3) =1/3 ∙ 27 = 9 г/моль Количествомоль - эквивалентов можно определить по формуле m nэкв = —— Mэкв Молярная масса эквивалента и эквивалент элемента не являются постоянной величиной в соединении, а зависят от валентности или степени окисления элемента. Например: Мэкв(С) в
Мэкв(С) в Постоянными являются эквиваленты Мэ (Н) = 1,008 г/моль Мэ(О) = 8 г/моль, Мэ (Аl) = 9 г/моль , Мэ ( Са) = 20 г/моль. Если не учитывать конкретную химическую реакцию, то фактор эквивалентности и молярная масса эквивалентов сложных веществ рассчитываются по формулам:
Мэ где М – молярная масса вещества В - валентность функциональной группы N - число функциональных групп Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла и т.д. (H+, OH-, Kat +n, An-n) Для определения эквивалентной массы сложного вещества в реакции следует разделить его полную массу (М) на сумму замещенных радикалов (H+, OH-, Kat+n, Ann-)
NaH+ SO4 + NaCl = Na2SO4 + HCl ƒэ NaHSO4 = 1
ZnOH-NO3 + HNO3 = Zn(NO3)2 + H2O ƒэ ZnOHNO3 =1
H2SO4 + NaCl = NaHSO4 + HCl ƒэ HSO4 = 1
NaHCO3 + CaSO4 = CaCO3↓ + NaHSO4 ƒэ NaHCO3 = 1/2
Fe(OH)2Cl + 2HCl = FeCl3 +2H2O ƒэ Fe(OH)2Cl =1/2
H2SO4 + 2KOH = K2SO4 +2H2O ƒэ H2SO4 =1/2
AlOH- SO4-2 + 3HCl = AlCl3 + H2SO4 + H2O ƒэ AlOHSO4 = 1/3
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O ƒэ Al(OH)3 = 1/3
KAl( SO4 )2 + 2BaCl 2 = KCl + AlCl3 + 2BaSO4↓ ƒэ KAl(SO4)2 = 1/4
1) для кислот: ƒэкв равен единице, деленной на основность кислоты, которая определяется числом ионов водорода 1/Z = ƒэкв (HCl) = 1 1/Z = ƒэкв (H2 SO4) = 1/2 1/Z = ƒэкв (H3 PO4) = 1/3 Молярная масса эквивалента кислоты равна произведению фактора эквивалентности на молярную массу кислоты
Мк Мэ кислоты =ƒэкв ∙ Мк = — Nн+ где: Мк - молекулярная (формульная) масса кислоты Nн+ - число атомов водорода, способных замещаться на металл. Пример: Мэ (H2 SO4) = 1/2 ∙ 98 = 49 г/моль Молярная масса эквивалента кислоты может быть рассчитана как сумма молярных масс эквивалентов водорода и кислотного остатка : Мэ (H2 SO4) = Мэ (Н+) + Мэ (SO4 2-) = 1 + 48 = 49 г/моль
2) для оснований ƒэкв равен единице, деленной на кислотность, равную числу гидроксогрупп, вступающих в реакцию ƒэкв ( NaOH) = 1/Z ( NaOH) = 1 ƒэкв (Ca(OH)2) = 1/Z (Ca(OH)2) = 1/2 Молярная масса эквивалента основания равна произведению фактора эквивалентности на молярную массу основания Мосн Мэ основания =ƒэкв ∙ Мосн = —— Nон- Пример Мэ [ Cr(OH)3 ] = 1/3 ∙ 103 = 34,3 г/моль Молярная масса эквивалента основания может быть рассчитана как сумма молярных масс эквивалентов металла и гидроксогруппы Мэ [ Cr(OH)3 ] = 52/3 + 17 = 34,3 г/моль
3) для солей: ƒэкв соли равен единице, деленной на произведение числа атомов металла в молекуле соли на степень окисления металла. ƒэкв (Na2SO4) = 1/Z (Na2SO4) =1/2
ƒэкв Al2(SO4)3 = 1/2 ∙ 3 Молярная масса эквивалента соли равна произведению фактора эквивалентности на молярную массу соли Мэ соли =ƒэкв соли ∙ Мс = Nме – число атомов металла
3 4 2 Мэ Al2(SO4)3= ——— = 57 г/моль 2 ∙ 3 Молярная масса эквивалента соли может быть рассчитана как сумма молярных масс металла и кислотного остатка Мэ Al2(SO4)3 = 27/3 +48 = 57г/моль
4) для оксидов ƒэкв равен единице, деленной на произведение числа атомов кислорода на степень окисления кислорода
ƒэкв ( H2O) = 1/Z ( H2O) = 1/2
ƒэкв (SO2) = 1/Z (SO2) = 1/4 ƒэкв (Mn2O7) = —— 7∙ 2 Молярная масса эквивалента оксида равна произведению фактора эквивалентности на молярную массу оксида М окс Мэ оксида = ƒэкв ∙ Мокс = ——— No ∙ noО. где: Nо - число атомов кислорода nоО – степень окисления кислорода в оксиде, которая равна всегда - 2. Мокс Мэ оксида = ——— Nо ∙ 2 Например: Мэ (Mn2O7) = —— = 15,9 г/моль 7 ∙ 2 Молярная масса эквивалента оксида может быть рассчитана как сумма молярных масс эквивалентов элемента и кислорода Мэ ( Mn2O7) = 55/7 + 8 = 15,9 г/моль В ОВР для определения ƒэкв необходимо единицу разделить на число отданных или присоединенных электронов. Вещества вступают в реакцию в эквивалентных количествах: 2Н2 + О2 = 2Н2О 4экв 4экв 4экв В 1792 г. немецким физиком Рихтером был сформулирован закон эквивалентов: массы реагирующих друг с другом веществ (m1,m2) пропорциональны молярным массам их эквивалентов (МЭ1,МЭ2) m1 Mэ1 m1 m2 —— = ——— < = > —— = —— m2 МЭ2 MЭ1 МЭ2 Из математической записи закона эквивалентов следует, что количество моль - эквивалентов веществ в реакции равны между собой. n экв1 = nэкв2
Для реакций с участием газов используют молярный объем эквивалента – это объем, занимаемый 1 моль-эквивалентом газа. Так, МЭ(Н) = 1г/моль, если моль газа 2г/моль занимают V=22,4л, то 1 эквивалент – в два раза меньший объем, равный 11,2 л. VЭКВ (Н2) = 22,4 : 2 = 11,2л.
Аналогично МЭКВ(О)= 1/4М(О2) = 32 : 4 = 8г/моль, отсюда Vэ(О2) = 22,4 : 4 = 5,6л. Тогда математическая запись закона через эквивалентный объем: mв-ва Vгаза mв-ва МЭв-ва —— = —— <=> —— = —— MЭв Vэгаза Vгаза VЭг

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 = 12 ∙ 1/2 = 6 г/моль
= 12 ∙ 1/2 = 6 г/моль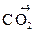 = 12 ∙ 1/4 = 3 г/моль
= 12 ∙ 1/4 = 3 г/моль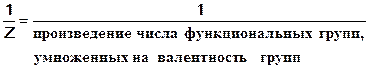 ;
; =
= 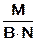 ,
,

 - степень окисления металла
- степень окисления металла