
|
|
Способы выражения концентрации растворов
Концентрация вещества – физическая величина (размерная или безразмерная), определяющая количественный состав раствора или смеси. Приведем наиболее употребительные способы выражения концентрации растворов. Молярная концентрация вещества В,или концентрация количества вещества (символ сВ, единица моль/м3 или моль/л), представляет собой отношение количества растворенного вещества В к объему раствора:
Часто используют сокращенную форму записи единицы молярной концентрации М≡моль/л. Термин «молярность» использовать не рекомендуется. Вместо него следует применять термин «молярная концентрация». Молярная концентрация эквивалентов вещества В (символ сэк(В), единица – моль/м3 или моль/л) равна отношению количества вещества эквивалентов В nэк(В) к объему раствора Vp:
Сокращенное обозначение единицы молярной концентрации эквивалентов вещества – н, н≡моль/л. Молярная концентрация эквивалентов вещества В в zB раз больше его молярной концентрации. Применение ранее использовавшихся терминов «нормальность» и «нормальная концентрация», а также обозначения N не рекомендуется. Произведение молярной концентрации эквивалентов вещества В на объем раствора Vp равно количеству эквивалентов этого вещества. Поэтому для реакции, в которой участвуют равные количества эквивалентов веществ А и В, справедливо соотношение (1.11), лежащее в основе титриметрических (объёмных) методов анализа: cэк(А).Vp(A)=cэк(В).Vp(B) (1.11) Моляльная концентрация (моляльность) вещества В в растворе(символ сm(B), единица – моль/кг) – это количество растворенного вещества В, деленное на массу ms растворителя:
Титр раствора вещества В(символ Т, единица – г/мл) – концентрация стандартного раствора, равная массе вещества В (mВ), содержащегося в 1мл раствора:
Используют также титр по определяемому веществу( символ Т(В/Х),единица – г/мл) – это масса определяемого вещества Х, которой соответствует 1мл рабочего раствора титранта. Молярная доля растворенного вещества В (символ хВ, безразмерная величина) равна отношению количества этого вещества (nB) к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель:
Принято обозначать нижним индексом (1) растворитель, а индексами (2,3,…,i) – растворенные вещества. Массовая доля растворенного вещества В (символ ωВ, безразмерная величина) равна отношению массы растворенного вещества В к массе раствора (mp):
Пример 1.10.Вычислить молярную концентрацию, молярную концентрацию эквивалентов и моляльность сульфата меди в растворе с концентрацией Решение.Найдем значение молярной массы и молярной массы эквивалентов CuSO4, учитывая, что число эквивалентности соли равно двум: Массу 1 литра раствора составит: m = ρ∙V = 1,107 г/см3∙1000 см3 = 1107 г. В 100г раствора с ω = 0,1 содержится 10г CuSO4 и 90г воды. Следовательно, массу сульфата меди, содержащуюся в 1л или, что то же самое, в 1107г раствора, можно найти из пропорции: 100г раствора содержат 10г CuSO4 1107г раствора содержат m г CuSO4 m = 110,7г CuSO4. Следовательно, молярная концентрация CuSO4, т.е. число моль CuSO4, содержащихся в 1 л раствора, составит
Молярная концентрация эквивалентов CuSO4, т.е. число моль эквивалентов сульфата меди в 1л раствора, составит
Чтобы определить моляльную концентрацию CuSO4, т.е. число моль сульфата меди, приходящихся на 1000г растворителя (воды), найдем вначале, сколько граммов CuSO4 приходится на 1кг растворителя. Для этого составляем пропорцию: 10г CuSO4 приходится на 90г Н2О х г CuSO4 приходится на 1000г Н2О х = 111,11г CuSO4. Это соответствует моляльности Сm = 111,11 / 160 = 0,696 моль/кг.
Пример 1.11 .Вычислить молярную долю кислоты в растворе с массовой долей H2SO4, равной 0,25. Решение. Молярная доля вещества в растворе равна отношению числа моль данного вещества к общему числу моль всех веществ, содержащихся в растворе. В 100г раствора серной кислоты с массовой долей 0,25 содержится 25г H2SO4 и 75г H2O. Определим число моль H2SO4 и воды.
Сумма молярных долей всех компонентов раствора равна 1 (0,058+0,942=1). Пример 1.12.Определить титр гидроксида калия 0,1н раствора КОН и титр этого раствора по серной кислоте. Решение. Титр раствора (Т) показывает количество граммов растворенного вещества, содержащегося в 1мл раствора. Число эквивалентности КОН равно 1, следовательно, молярная масса эквивалентов равна молярной массе МКОН = Мэк(КОН)=56,0 г/моль. В 1 л децинормального (0, 1н) КОН содержится mKOH=МКОН. Сэк(КОН)=56.0,1=5,6г. Значит, титр этого раствора равен
Раствор гидроксида калия может быть использован для определения серной кислоты, например, по реакции 2KOH + H2SO4 = K2SO4 + H20 Из уравнения реакции следует, что 2 моль KOH реагирует с 1 моль H2SO4 или 112г (2.56=112) щелочи реагируют с 98г кислоты. Следовательно, титр этого раствора по серной кислоте или массу серной кислоты, вступающую во взаимодействие с 1 мл 0,1 н КОН, можно определить из пропорции 112г КОН реагируют с 98г H2SO4 0,0056г КОН реагируют с m г H2SO4
Пример 1.13. На нейтрализацию 0,035 л 0,3 н раствора H3PO4 израсходовано 0,02 л раствора NaOH. Определить молярную концентрацию эквивалентов NaOH в растворе. Решение. Произведение молярной концентрации эквивалентов вещества В на объем раствора Vp равно количеству эквивалентов этого вещества. Поэтому для реакции, в которой участвуют равные количества эквивалентов веществ А и В, можно записать (ф-ла (1.12)): cэк(А).Vp(A)=cэк(В).Vp(B). В нашем случае n ЭК (H3PO4) = nЭК (NaOH). Следовательно, сЭК(H3PO4)∙Vp(H3PO4)=сЭК(NaOH)∙Vp(NaOH). Находим СЭК (NaOH):
Контрольные вопросы и задачи* 1.1.Сформулируйте закон сохранения массы и границы применимости этого закона. 1.2. Реакция разложения карбоната кальция сопровождается поглощением 179 кДж энергии. Найти изменение массы реагирующих веществ (г, %) в ходе реакции. Ответ:2.10-12кг;2.10-9%. 1.3. Сформулируйте закон постоянства состава и область применения этого закона. 1.4. Сформулируйте закон эквивалентов. К каким реакциям применим этот закон? 1.5. Сформулируйте понятия: эквивалент, число эквивалентности, фактор эквивалентности. 1.6. Сформулируйте понятия:количество вещества эквивалентов, молярная масса эквивалентов, молярный объем эквивалентов. * При решении задач используются округлённые до единиц значения молярных масс, за исключением МCl=35,5г/моль. 1. 7.Определить числа эквивалентности:1) атомарного и молекулярного фтора; 2) магния; 3) оксида серы (IV); 4) гидроксида калия; 5) угольной кислоты; 6) нитрата кальция. Ответ: 1)1, 2; 2)2; 3)4; 4) 1; 5) 2; 6)2. 1.8.Определить молярную массу эквивалентов следующих веществ: 1)V2O5; 2) серы в соединении Н2S; 3) соли Na2HPO4 в реакции Na2HPO4 + HCl = NaH2PO4 + NaCl. Ответ: 1)36,4; 2)16; 3)142. 1. 9.Хлорид металла содержит 25,8 % металла. Вычислить молярную массу эквивалентов металла, если молярная масса эквивалентов хлора составляет 35,5 г/моль. Ответ:12,3 г/моль. 1.10.Для реакции с 2г металла потребовалось 1,12дм3 хлора (нормальные условия (н.у.)). Вычислить молярные массы эквивалентов металла и его оксида. Ответ:20; 28 г/моль. 1.11. Сформулируйте закон Авогадро. 1.12.Какой объем занимает 1,7г аммиака при н.у.? Ответ:1,12л. 1.13. Определите относительную плотность кислорода по гелию. Ответ: 8. 1.14.Относительнаяплотность газа по азоту составляет 5,214. Вычислите молярную массу газа и объём 2,92г этого газа при н.у.? Ответ:146г/моль; 0,448л. 1.15.Найти массу одной формульной единицы едкого натра. Ответ:6,64.10-26кг. 1.16. Дайте определениямолярной концентрации, молярной концентрации эквивалентов, моляльной концентрации, титр раствора, титра по определяемому веществу, молярной доли и массовой доли. 1.17. В каких случаях для пересчёта одной концентрации в другую необходимо знание плотности раствора: а )массовая доля и молярная концентрация; б) молярность и молярная концентрация эквивалентов; в) титр раствора и молярная доля; г) молярная концентрация эквивалента и массовая доля; д) моляльная концентрация и молярность; е) молярная концентрация и титр раствора?. Ответ: а) да; б) нет; в) да; г) да; д) да; е)нет. 1.18. Вычислите молярную концентрацию и моляльность сульфата железа (II) в растворе с концентрацией 1.19. Вычислите молярную концентрацию эквивалентов и молярную долю карбоната натрия в растворе с концентрацией Ответ:1,632 моль/л; 0,0287. 1.20.Найти титр раствора с концентрацией ωKI =0.01 и плотностью ρ = 1,005г/см3. Ответ:0,01005 г/мл. 1.21.Вычислить массовую долю азотной кислоты в 1,32М растворе с плотностью ρ = 1,043г/см3. Ответ:0,08. 1.22. Сколько граммов Na2S2O3 потребуется для приготовления 2л раствора с концентрацией 0,02н, если число эквивалентности равно 1? Ответ: 6,32 г. 1.23.Сколько миллилитров 0,01н раствора KMnO4 можно приготовить из 10 мл 0,5 М раствор, если число эквивалентности равно 5? Ответ: 2500 мл. 1.24. Для нейтрализации 25 мл 0,1н раствора кислоты потребовалось 15 мл раствора щёлочи. Найти молярную концентрацию эквивалентов щёлочи. Ответ: 0,167. 1.25. Найти массу дихромата калия, содержащуюся в 1л раствора, если 10 мл этого раствора прореагировали с 20 мл 0,1нраствора иодида калия.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (1.9)
(1.9) .(1.10)
.(1.10) (1.12)
(1.12) (1.13)
(1.13)
 . (1.14)
. (1.14)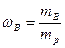 (1.15)
(1.15)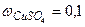 и плотностью ρ = 1,107г/см3.
и плотностью ρ = 1,107г/см3.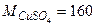 г/моль;
г/моль;  г/моль.
г/моль.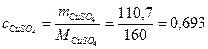 моль/л.
моль/л. моль/л.
моль/л. моль/кг Н2О.
моль/кг Н2О. моль;
моль; моль.
моль. ;
; .
. г/мл.
г/мл. г/мл.
г/мл.
 и плотностью ρ = 1,057г/см3. Ответ:0,417моль/л; 0,420 моль/кг Н2О.
и плотностью ρ = 1,057г/см3. Ответ:0,417моль/л; 0,420 моль/кг Н2О.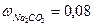 и плотностью ρ = 1,081г/см3.
и плотностью ρ = 1,081г/см3. Ответ: 58,8г.
Ответ: 58,8г.