
|
|
Атомно-молекулярная теорияОсновные законы химии Закон сохранения массы. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.Открыт в 1748г. М.В.Ломоносовым. Закон сохранения и превращения энергии. Энергия не исчезает и не возникает вновь; ее различные формы могут переходить одна в другую в определенных, строго эквивалентных отношениях. В 1905г. А.Эйнштейн показал, что между энергией и массой существует взаимосвязь, выражаемая формулой
где ΔЕ _ изменение энергии (Дж), соответствующее изменению массы Δm (кг); с – скорость света в вакууме (2,99792. 108м.с-1). Из уравнения (1.1) следует, что любой химический процесс, сопровождающийся выделением или поглощением энергии, сопровождается соответственно уменьшением или увеличением массы. Тепловой эффект в 1 кДж соответствует изменению массы на 1,1.10-14кг. Величина тепловых эффектов химических реакций редко превышает 103 кДж/моль. По этой причине изменением массы веществ в ходе химических реакций обычно пренебрегают как незначительным. Пример 1.1.Реакция между2 моль водорода и 1 моль кислорода сопровождается выделением 284 кДж теплоты. Рассчитать абсолютное и относительное (%) изменение массы реагирующих веществ в ходе реакции. Решение. Из уравнения (1.1) следует, что абсолютное уменьшение массы реагирующих веществ
Следовательно, относительное уменьшение массы
Закон постоянства состава. Любое химически чистое соединение имеет постоянный состав и свойства независимо от способа и места его получения.Закон был сформулирован французским химиком Ж.Прустом в начале XIX века. Позднее было установлено, что все химические вещества делятся на соединения постоянного состава (дальтониды) и соединения переменного состава (бертоллиды). К дальтонидам принадлежат большинство кислот, оснований, солей. К бертоллидам относятся многие двойные соединения, особенно соединения d-элементов. Например, в зависимости от способа получения моносульфид железа существует в интервале составов FeS0,8-1,14. Закон постоянства состава применим только к соединениям постоянного состава. Закон эквивалентов. Закон открыт И.Рихтером в период 1792-1802 гг. Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов. В законе используется понятие эквивалент _ это условные или реальные частицы вещества, в zB раз меньшие, чем соответствующие им формульные единицы. Формульная единица вещества _ это реально существующие частицы, таки, как атомы (Н, С, О), молекулы ( N2, Н2О, H2SO4), ионы Число zB называют числом эквивалентности или эквивалентным числом, Величина, обратная числу эквивалентности, называется фактором эквивалентности fB=1/zB. Пример 1.2.Определить число эквивалентности: 1) серной кислоты в реакциях 1а) H2SO4 + 2NaOH = Na2SO4 + 2H2O 1в) H2SO4 + NaOH = NaHSO4 + H2O 2) фосфора в реакциях 2а) 4Р + 3О2 =2Р2О3 2в) 4Р + 5О2 =2Р2О5 Решение. 1) В обменной реакции нейтрализации (1а) 1 формульная единица (ФЕ) серной кислоты реагирует с 2 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты В реакции (1в) 1 ФЕ серной кислоты реагирует с 1 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты 2) Взаимодействие фосфора с кислородом относится к окислительно-восстановительным реакциям. В этом случае число эквивалентности равно числу электронов, принимаемых 1ФЕ окислителя, или числу электронов, отдаваемых 1ФЕ восстановителя. В реакции (2а) фосфор выступает в роли восстановителя и имеет место процесс Р –3е = Р3+ Следовательно, число эквивалентности фосфора zР=3. В реакции (2а) имеем Р –5е = Р5+ и zР=5. Число эквивалентности может быть формально определено по формуле вещества. Для простого вещества число эквивалентности равно абсолютной величине степени окисления, проявляемой одним атомом; для бинарных соединений – абсолютной величине суммы положительных или отрицательных степеней окисления атомов, составляющих соединение; для оснований, кислот и солей _ абсолютной величине суммы положительных или отрицательных зарядов ионов, образующих соединение. Пример 1.3.Определить числа эквивалентности: 1) кислорода; 2) азота; 3) оксида азота (IV); 4) гидроксида кальция; 5) серной кислоты; 6) сульфата алюминия. Решение. 1) Кислород проявляет степень окисления (-2), следовательно, число эквивалентности атомарного кислорода (О) zO=2, а число эквивалентности молекулярного кислорода (О2 ) 2) Азот может иметь степени окисления (-3, -2, 0, +1, +2, +3, +4, +5). Следовательно, атомарный азот (N) может иметь числа эквивалентности 1, 2, 3, 4, 5, а молекулярный азот (N2), соответственно, 2, 4, 6, 8, 10. 3) Формула оксида азота (IV) – NO2. Степень окисления азота составляет (+4), а атома кислорода _ (-2). Абсолютная величина суммы положительных или отрицательных степеней окисления составляет число эквивалентности 4)Гидроксид кальция Са(ОН)2 диссоциирует по уравнению
Абсолютная величина суммы зарядов положительного иона кальция (катиона) или двух отрицательных ионов гидроксида (анионов) равна 2. Следовательно, 5)Серная кислота диссоциирует по уравнению
Абсолютная величина суммы зарядов двух положительных ионов водорода или отрицательного иона (сульфат-иона) равна 2. Следовательно, 6) Сульфат алюминия Al2(SO4)3 диссоциирует по уравнению
Абсолютная величина суммы зарядов двух положительных ионов алюминия или трех отрицательных ионов (сульфат-ионов) равна 6. Следовательно, Подчеркнем, что определение числа эквивалентности по формуле носит формальный характер, т.к. не связано с конкретной химической реакцией. Применение закона эквивалентов требует введения понятия количества вещества эквивалентов В(символ nэк(В), единица _ моль) _ физическая величина, пропорциональная числу эквивалентов вещества В, Nэк(В):
где NA _ постоянная Авогадро. Например: nэк(3;Н3РO4)= 1,5 моль, nэк(2;Са2+)= 2 ммоль. Цифры 3 и 2 _ значения чисел эквивалентности. Так как в одной формульной единице вещества В содержится zB эквивалентов этого вещества, то справедливо соотношение nэк(В)=zВnB , (1.3) где nB _ количество вещества В, моль. В расчетах на основе закона эквивалентов используется также понятие молярной массы эквивалентов вещества В (символ Мэк(В),единица _ кг/мольили г/моль) _ это отношение массы вещества В (mB) к количеству вещества эквивалентов В (nэк(В)):
Молярная масса эквивалентов вещества В всегда в zB раз меньше молярной массы этого же вещества. Поэтому для вычислений можно использовать также следующую формулу:
Для газообразных веществ используют также понятие молярного объема эквивалентов вещества В (символ Vэк(В),единица _ л/мольили дм3/моль). Эта величина может быть найдена как отношение молярного объема вещества В (VB) к числу эквивалентности вещества В (zэк(В)):
Пример 1.4.Определить молярную массу эквивалентов следующих веществ: 1)Cr2O3; 2) фосфора в соединении РН3; 3) соли NaH2PO4 в реакции NaH2PO4 + 2NaOH = Na3PO4 + 2 H2O. Решение. 1) Степень окисления атома кислорода в оксиде Cr2O3 составляет (-2). Абсолютная величина суммы степеней окисления трех атомов кислорода - 6. Следовательно, число эквивалентности оксида равно 6. Молярная масса Cr2O3
Таким образом, молярная масса эквивалентов Cr2O3
2) Степень окисления атома водорода в гидриде фосфора (фосфин) РН3 составляет (+1). Абсолютная величина суммы степеней окисления трех атомов водорода составляет 3. Следовательно, степень окисления фосфора равна (-3) и число эквивалентности фосфора равно 3. Молярная масса фосфора составляет 31 г/моль, а молярная масса эквивалентов фосфора в фосфине
3) Одна формульная единица дигидрофосфата натрия (NaH2PO4) реагирует с двумя формульными единицами гидроксида натрия. Число эквивалентности гидроксида натрия равно 1, следовательно, число эквивалентности NaH2PO4 в данной реакции составляет 2. Таким образом, молярная масса эквивалентов NaH2PO4 будет
=(23+2.1+31+4.16)/2=60 г/моль. Пример 1. 5.Сульфид металла содержит 67,15 % металла. Вычислить молярную массу эквивалентов металла, если молярная масса эквивалентов серы составляет 16 г/моль. Решение. Из условия задачи следует, что 100 г сульфида металла содержит 67,15 г металла и 32,85 г серы. Согласно закону эквивалентов эти массы пропорциональны молярным массам эквивалентов металла и серы. Следовательно, 67,15 г металла эквивалентны 32,85 г серы Мэк(Ме) эквивалентна Мэк(S)=16 г/моль серы. Откуда
Пример 1.6.На восстановление 1г оксида металла израсходован 421 см3 водорода (нормальные условия (н.у.)). Вычислить молярные массы эквивалентов оксида и металла. Решение. Число эквивалентности молекулярного водорода Н2 равно двум, следовательно, молярная масса эквивалентов водорода
В соответствии с законом Авогадро объем 1 моль водорода при н.у. составляет 22,4 л, следовательно, молярный объем эквивалентов водорода при н.у.
1г оксида эквивалентен 421 см3 водорода Мэк(оксид) эквивалентна 11200 см3/моль водорода. Откуда
Любой оксид состоит из кислорода и другого элемента, соединенных в эквивалентных количествах. Следовательно, молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и металла, образующего оксид: Мэк(оксид)=Мэк( металл) + Мэк(О) Число эквивалентности кислорода zO=2, значит,
Таким образом, молярная масса эквивалентов металла, образующего оксид, составляет Мэк( металл)= Мэк(оксид) - Мэк(О)= 26,6 – 8 =18,6 г/моль. Закон Авогадро.Открыт в 1811г. итальянским физиком А.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул. При нормальных условиях (температура 0 оС=273,15 К и давление 1 атм =760 мм рт.ст.= 101325 Па=101,325кПа) один моль любого газа содержит 6,022045.1023 Закон Авогадро позволяет определить молярную массу газа, если известна его плотность (ρ) при нормальных условиях: МВ=22,4 ρ, (1.7) или плотность при нормальных условиях, если известна молярная масса. Можно также определить молярную массу неизвестного газа (Мх), зная молярную массу известного газа (МВ) и отношение плотностей этих газов (ρх/ρВ):
Отношение ρх/ρВ носит название относительной плотности одного газа по другому и обозначается буквой D. Например, если использовать относительную плотность неизвестного газа по водороду и воздуху, то формула (1.8) запишется следующим образом:
Если условия, при которых находится газ, не сильно отличаются от нормальных, то для определения молярной массы газа используют уравнение состояния идеальных газов Менделеева _ Клапейрона. Пример 1.7.Какой объем занимает 1г углекислого газа при н.у.? Решение. Молярная масса углекислого газа СО2 составляет 44 г/моль. Из закона Авогадро следует, что при нормальных условиях 44г углекислого газа занимают объем 22,4л 1г углекислого газа занимают объем Vo л. Следовательно,
Пример 1.8.Относительнаяплотность газа по водороду составляет 6. Какой объем будут занимать 2г этого газа при н.у.? Решение. Определяем молярную массу газа по уравнению (1.8а): М = 2,016.6= 12,096 г/моль. В соответствии с законом Авогадро 12,096г газа занимают объем 22,4л 2г газа занимают объем Vо л. Откуда
Закон кратных отношений. Открыт английским ученым Д.Дальтоном в 1804г. Если два элемента образуют между собой несколько химических соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа. Например, массы азота и кислорода в соединениях N2O и NO относятся как 0,875:1 и 0,4375:1. Следовательно, массы азота, соединяющиеся с одной и той же массой кислорода, относятся между собой как 2:1. Рассмотренные в этом параграфе и некоторые другие законы легли в основу атомно-молекулярной теории _ основы современной химии. Атомно-молекулярная теория Основные положения теории были сформулированы Д. Дальтоном в начале XIX в. и заключаются в следующем: 1. Каждый элемент состоит из мельчайших частиц, называемых атомами. 2. Все атомы одного элемента одинаковы. 3. Атомы разных элементов обладают разными свойствами. 4. Атомы не создаются и не разрушаются в химических реакциях. 5. В результате комбинации атомов двух или нескольких элементов образуются молекулы. 6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны. Для характеристики атомов и молекул используют понятия относительной атомной массы (Аr), относительной молекулярной массы (Mr) и молярной массы вещества (МВ). Масса атома любого элемента (абсолютная атомная масса атома) равна произведению его относительной атомной массы на атомную единицу массы (а.е.м.): mэ = Ar. (а.е.м.). 1 а.е.м. = 1,6606.10-27кг. Пример 1.9.Найти массу атома кислорода (абсолютную массу атома кислорода). Решение. Масса атома кислорода составляет Ао = 16 . 1,66.10-27 = 2,656.10-26кг = 2,656.10-23г.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
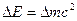 , (1.1)
, (1.1)
 Из условия задачи вытекает, что исходная масса реагирующих веществ
Из условия задачи вытекает, что исходная масса реагирующих веществ
 .
. или условно существующие частицы (NaCl, К2SO4) и т.д.
или условно существующие частицы (NaCl, К2SO4) и т.д. Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может изменяться.
Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может изменяться.








 (1.2)
(1.2) (1.4)
(1.4)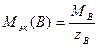 (1.5)
(1.5) (1.6)
(1.6) г/моль.
г/моль. г/моль.
г/моль. г/моль.
г/моль.
 г/моль.
г/моль. г/моль.
г/моль. л/моль = 11200 см3/моль.
л/моль = 11200 см3/моль. В соответствии с законом эквивалентов масса оксида и объем водорода, вступившие в реакцию, пропорциональны молярным массам (молярным объемам) их эквивалентов. Значит,
В соответствии с законом эквивалентов масса оксида и объем водорода, вступившие в реакцию, пропорциональны молярным массам (молярным объемам) их эквивалентов. Значит, г/моль.
г/моль. г/моль
г/моль 6,02.1023 молекул (постоянная Авогадро) и занимает объем 22 414 см3
6,02.1023 молекул (постоянная Авогадро) и занимает объем 22 414 см3  (1.8)
(1.8) (1.8а)
(1.8а)
 л.
л. л.
л.