
|
|
Массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.Математически закон эквивалентов для условной реакции вида А + В ® С + D можно выразить следующим образом
Если в реакции участвуют газообразные вещества, то закон эквивалентов целесообразнее записать как соотношение объемов
Наконец, когда один из участников реакции - газ, а другой – твердый реагент, то формула, выражающая закона эквивалентов, принимает вид
Пример 1. при сгорании 5 г металла образуется 9,44 г оксида металла. Вычислите молярную эквивалентную массу металла. Определите относительную атомную массу металла, если его валентность в оксиде равна трем.
Р е ш е н и е По закону эквивалентов МЭ(Ме) = Молярную эквивалентную массу оксида можно представить как сумму МЭ металла и кислорода МЭ(оксида) = МЭ(Ме) + МЭ(О). Вычислим МЭ(О), зная что степень окисления кислорода в оксиде равна –2
МЭ(О) = Тогда МЭ(Ме) = Относительную атомную массу металла найдем по формуле Аr(Ме) = МЭ(Ме)×В = 9 × 3 = 27.
Пример 2. Мышьяк образует оксид, содержащий 65,2 % мас. мышьяка. Вычислите молярную эквивалентную массу мышьяка и определите простейшую формулу оксида.
Р е ш е н и е 1. Оксид мышьяка состоит из элементов As и О. Тогда закон эквивалентов можно записать так
Отношение масс элементов в оксиде равно отношению массовых долей (% мас.) этих элементов, то есть
Тогда МЭ(As) = 2. Для того чтобы записать химическую формулу оксида, вычислим валентность мышьяка в оксиде по формуле В = Следовательно, химическая формула оксида мышьяка As2O5 .
Пример 3. На восстановление 3,6 г оксида металла израсходовано 1,7 дм3 водорода при н.у. Найдите молярную эквивалентную массу металла.
Р е ш е н и е 1. По закону эквивалентов МЭ(оксида) = 2. Так как МЭ(оксида) это сумма молярных эквивалентных масс металла и кислорода, то МЭ(Ме) = МЭ(оксида) - МЭ(О) = 23,7 – 8 = 15,7 г/моль. Пример 4.Из 3,31 г нитрата металла получено 2,78 г хлорида металла. Вычислите молярную эквивалентную массу оксида металла.
Р е ш е н и е Закон эквивалентов в данном случае примет вид
МЭ хлорида и нитрата металла можно представить таким образом МЭ(нитрата) = МЭ(Ме) + МЭ(NO3-) , МЭ(хлорида) = МЭ(Ме) + МЭ(Cl-) . Вычислим молярные эквивалентные массы ионов нитрата и хлорида МЭ(NO3-) = МЭ(Cl-) = Тогда по закону эквивалентов
а молярная эквивалентная масса оксида металла равна МЭ(оксида) = МЭ(Ме) + МЭ(О) = 104 + 8 = 112 г/моль. З А Д А Ч И 1. 2,14 г металла вытесняют из кислоты 2 дм3 водорода при нормальных условиях. Определите молярную эквивалентную массу оксида металла. 2. На восстановление 3,6 г оксида металла израсходовано 1,7 дм3 водорода при нормальных условиях. Вычислите молярную эквивалентную массу металла. 3. Олово образует два оксида. Первый содержит 78,8 % мас. олова, а второй - 88,2 % мас. Вычислите молярные эквивалентные массы олова в данных оксидах. Составьте простейшие формулы оксидов. 4. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную эквивалентную массу металла. 5. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную эквивалентную массу металла. 6. Одно и тоже количество металла соединяется с 0,0006 кг кислорода и с 0,009534 кг галогена. Вычислите молярную эквивалентную массу галогена. 7. Вычислите молярную эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовали 0,28 дм3 водорода при нормальных условиях. 8. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную эквивалентную массу металла и его оксида. Чему равна молярная масса металла? 9. На сжигание 1,5 г двухвалентного металла требуется 0,69 дм3 кислорода при нормальных условиях. Вычислите молярную эквивалентную массу и атомную массу данного металла. 10. Из 3,31 г сульфата металла получается 2,08 г хлорида металла. Определите молярную эквивалентную массу металла. 11. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г гидроксида калия. Вычислите молярную эквивалентную массу кислоты и определите ее основность в данной реакции. 12. При окислении 16,74 г металла образовалось 21,54 г оксида. Вычислите молярную эквивалентную массу металла и его оксида. 13. При взаимодействии 3,24 г металла (валентность равна 2) с кислотой выделилось 4,03 дм3 водорода при нормальных условиях. Определите молярную эквивалентную массу металла и его относительную атомную массу. 14. Сульфид мышьяка содержит 38 % мас. серы. Молярная масса эквивалента серы равна 16 г/моль. Вычислите молярную эквивалентную массу мышьяка и запишите химическую формулу сульфида. 15. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовали 7,998 г NaOH. Вычислите молярную эквивалентную массу кислоты и ее основность в данной реакции. 16. 3,04 г некоторого металла вытесняют 0,252 г водорода, 26,965 г серебра и 15,885 г меди из соединений этих элементов. Вычислите МЭ данных металлов. 17. Оксид металла содержит 28,57 % мас. кислорода, а его фторид содержит 48,72 % мас. фтора. Вычислите молярные эквивалентные массы металла и фтора. 18. Вычислите молярную эквивалентную массу металла и его оксида, если на восстановление 1,8 г оксида израсходовано 833 см3 водорода при нормальных условиях. 19. Чему равна молярная эквивалентная масса меди, если цинк массой 13 кг замещает в растворе соли медь массой 12,633 кг? Эквивалент цинка принять равным ½. 20. 0,49 г хлорида металла взаимодействует с AgNO3, при этом получено 0,863 г AgCl. Вычислите эквивалентную массу металла. 21. На восстановление 7,09 г оксида двух валентного металла требуется 0,31 г водорода. Вычислите эквивалентную массу металла и его оксида. Чему равна атомная масса металла? Назовите этот металл. 22. Определите молярные эквивалентные массы металла и серы, если 3,24 г металла образуют 3,48 г оксида и 3,72 г сульфида. 23. Для растворения 16,8 г металла потребовалось 14,4 г серной кислоты. Определите молярную эквивалентную массу металла и объем выделившегося водорода (н.у.). 24. Некоторое количество металла, молярная эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 см3 водорода (н.у.). Определите массу металла. 25. Серная и ортофосфорная кислоты имеют одинаковую молярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат? 26. Оксид марганца содержит 22,56 % мас. кислорода. Вычислите молярную эквивалентную массу и стехиометрическую валентность марганца в оксиде. 27. Оксид марганца содержит 50,50 % мас. кислорода. Вычислите молярную эквивалентную массу марганца в оксиде. Составьте химическую формулу оксида. 28. Металл образует оксид Me2O3, содержащий 68,4 % мас. металла. Вычислите атомную массу этого металла. Какой это металл? 29. Молярная эквивалентная масса хлора равна 35,5 г/моль. Молярная масса атомов меди равна 63,5 г/моль. Молярная эквивалентная масса хлорида меди равна 99,5 г/моль. Запишите формулу хлорида меди. 30. Вычислите молярную эквивалентную и атомную массу двухвалентного металла, если на окисление 8,34 г этого металла израсходовано 680 см3 кислорода. Назовите этот металл.
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ 1. Составьте простейшую формулу интерметаллического соединения между магнием и алюминием, если 4,455 г данного соединения при растворении в соляной кислоте образуют водород, количество которого достаточно для восстановления 15,3 г оксида железа (II). 2. Порошок тиованадата аммония (NH4)3VS4 массой 26,6 г поместили в герметичный сосуд емкостью 9 дм3, заполненный азотом при н.у. После выдерживания при 60 °С произошел распад вещества с образованием аммиака, сероводорода и твердого сульфида ванадия (V). Определите общее давление в сосуде после охлаждения до 20 °С и парциальные давления каждого газа в смеси. 3. Какую массу 10 % мас. раствора азотной кислоты необходимо взять для растворения 1 г медно-никелевого сплава, содержащего 20 % мол. Ni, если медь восстанавливает азотную кислоту до NO, а никель – до N2O? Определите парциальные давления газов, выделившихся при растворении данной навески сплава при н.у. в сосуде объемом 10 дм3. 4. При прокаливании некоторого количества смеси карбоната свинца с оксидом свинца (II) собрано 37,3 см3 диоксида углерода при н.у. При растворении такой же навески смеси в азотной кислоте и осаждении всего свинца в составе его сульфата получено 0,808 г сухого осадка. Каков процентный состав первоначальной смеси? 5. При н.у. смешали 5 м3 воздуха (содержание кислорода 21 % об.) с 1 м3 коксового газа, имеющего состав 50 % об. Н2, 32 % об. СН4, 18 % об. СО. Полученную смесь подожгли. Каким будет состав газовой смеси в % об. При н.у., полученной после сгорания и конденсации водяных паров? 6. При горении аммиака без катализатора получаются азот и водяной пар, а в присутствии катализатора – оксид азота (II) и водяной пар. Определите состав смеси в % мас., полученной при сжигании 12 дм3 аммиака при н.у., если 35 % аммиака сгорело по первой реакции, а остальное – по второй. 7. Определите объемную долю (в %) каждого газа в смеси, состоящей из азота и оксидов углерода (II) и (IV), если при последовательном пропускании 5 дм3 такой смеси, взятой при н.у., через избыток известковой воды и над нагретым оксидом меди (II) выпало 10 г осадка и образовалось 6,4 г меди. 8. Определите массовые доли кальция и оксида кальция в смеси, если при прокаливании некоторого количества этой смеси с углем выделилось 2,24 дм3 газа при н.у. и образовалось 15,2 г твердого остатка. 9. При растворении в серной кислоте 2,5 г сплава цинка с магнием выделилось 1,3 дм3 водорода при температуре 26 °С и давлении 1,2×105 Па. Определите массовые доли компонентов сплава. 10. При прокаливании 8,69 г смеси карбонатов кальция и стронция получено 5,39 г твердого остатка. Определите мольные доли карбонатов кальция и стронция в смеси и объем выделившегося газа при н.у. 11. Определите формулу вещества, выпавшего в осадок при смешивании растворов хлорида меди (II) и карбоната калия, если известно, что при прокаливании 2,22 г этого осадка образуется 1,6 г нового твёрдого продукта. Среди выделяющихся при этом газов и паров содержится 0,18 г воды. 12. При обработке соляной кислотой 100 г стали содержащей в виде примеси сульфид железа (II), выделился сероводород, на поглощение которого было затрачено 22,7 г 10 % мас. раствора нитрата свинца. Вычислите массовую долю серы в стали. 13. Газ, полученный при разложении 425 г нитрата натрия, смешали в замкнутом сосуде с другим газом, образовавшимся при действии избытка гидроксида калия на 45 г алюминия. Смесь газов взорвали. Определите массу полученного продукта. 14. В замкнутом сосуде емкостью 2 дм3 находится смесь сероводорода с избытком кислорода при н.у. Смесь сожгли, и после растворения в воде продуктов реакции образовалось 220 г 1 % мас. раствора кислоты. Определите % об. Сероводорода в исходной смеси. 15. Диоксид серы растворили в воде. К полученному раствору прибавили бромную воду (Br2) до появления окраски брома, а затем избыток раствора хлорида бария. Полученный осадок отфильтровали, высушили и взвесили. Масса осадка составила 2,6 г. Сколько литров SO2 при н.у. было растворено в воде? 16. 1 г смеси опилок меди, магния и алюминия обработали избытком соляной кислоты. Раствор отфильтровали и добавили к нему избыток NaOH. Полученный осадок отделили от раствора, промыли водой и прокалили до постоянной массы 0,2 г. Не растворившийся остаток смеси опилок прокалили на воздухе до постоянной массы 0,8 г. Определите процентное содержание алюминия в исходной смеси. 17. Смесь газов N2, NO и NO2 общим объемом 88 см3 (н.у.) пропустили через воду. Объем газов, не поглощенных водой, составил 50 см3. К ним добавили 16 см3 кислорода, после чего объем смеси газов стал равен 55 см3. Определите % об. NO в исходной смеси. 18. При нагревании некоторой массы смеси хлорида калия и нитрата калия выделяется 0,56 дм3 газа при н.у., а при добавлении к такой же навеске смеси в растворе нитрата серебра выпадает 14,35 г осадка. Определите процентное содержание в смеси нитрата калия. 19. 60 г металла II А группы Периодической системы, взаимодействуя с азотом, образуют нитрид, который, реагируя с водой, образует гидроксид соответствующего металла и аммиак. При каталитическом окислении выделившегося аммиака образовалось 11,2 дм3 оксида азота (II) при н.у. Выход по последней реакции 50 %. Определите исходный металл. 20. К избытку серной кислоты добавили такое количество сульфита натрия, что при взаимодействии образовавшегося при этом газа с избытком сероводорода получено 9,6 г твердого вещества. Сколько грамм сульфита натрия было взято? 21. 12,8 г сплава меди с алюминием обработали избытком соляной кислоты. Остаток промыли и растворили в концентрированной азотной кислоте. Этот раствор выпарили, а сухой остаток прокалили. Масса вещества после прокаливания составила 4 г. Определите % мас. меди в сплаве. 22. После прокаливания 50 г смеси сульфата натрия, карбоната аммония и хлорида калия ее масса уменьшилась на 9,8 г. Полученный остаток растворили в воде и добавили избыток раствора хлорида бария. Масса выпавшего осадка составила 46,6 г. Определите % мас. хлорида калия в исходной смеси. 23. При взаимодействии 72,8 г смеси двухвалентного металла и его карбоната с соляной кислотой выделилось 8,96 дм3 газов при н.у. После сжигания смеси газов, и конденсации водяных паров объем газов уменьшился до 6,72 дм3. Рассчитайте процентное содержание металла в смеси. 24. При взаимодействии 19,2 г двухвалентного металла с разбавленным раствором кислоты образуется соль металла и выделяется 4,48 дм3 газа, содержащего 46,67 % мас. азота и кислород. Плотность газа по воздуху равна 15. Назовите металл. 25. При обработке смеси гидроксида калия и гидрокарбоната калия избытком раствора соляной кислоты образовалось 59,6 г хлорида калия и выделилось 4,48 дм3 газа при н.у. Рассчитайте % мас. гидрокарбоната калия в смеси.
Литература
1. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996. 2. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Высш. шк., 1997. 3. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии. М.: Высш. шк., 1990. 4. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991. 5. Коршунов Б.Г., Стефанюк С.Л. и др. Задачник по общей химии для металлургов. М.: Высш. шк., 1977. 6. Зайцев О.С. Познавательные задачи по общей химии. М.: Изд-во Моск. ун-та, 1982. 7. Михилев Л.А., Пассет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии. СПб: Химия, 1995. 8. Кузьменко Н. Е., Еремин В.В. Сборник задач и упражнений по химии. М.: Издательский дом «ОНИКС 21 век», 2001. 9. Кузьменко Н. Е., Еремин В.В. Сборник конкурсных задач. М.: Издательский дом «ОНИКС 21 век», 2001. 10. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
Содержание
Моль. Молярная масса .......................................................................................................... 3 Законы газового состояния .................................................................................................. 8 Эквивалент. Молярная масса эквивалента......................................................................... 14 Закон эквивалентов............................................................................................................... 21 Дополнительные задания...................................................................................................... 27 Литература ............................................................................................................................. 31

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
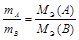 или
или  .
. .
. .
. .
.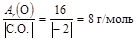 .
. или МЭ(Ме) = 9 г/моль.
или МЭ(Ме) = 9 г/моль.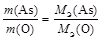 .
. .
. .
. .
. .
. .
. ,
, .
. . Отсюда МЭ(Ме) = 104 г/моль,
. Отсюда МЭ(Ме) = 104 г/моль,