
|
|
ЭКВИВАЛЕНТ. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА
Эквивалентом Э(Х)называется некая реальная или условная частица (атом, молекула, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом эквивалентна одному моль атомов или ионов водорода в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле Э(Х) = где z* - число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х. Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента МЭ(Х)(г/моль). Она связана с молярной массой частицы Х соотношением МЭ(Х) = М(Х)× Э(Х) = Значение числа эквивалентности z* элемента в каком-либо веществе равно модулю степени окисления (С.О.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле МЭ(Х) = Для веществ, не участвующих в данный момент в какой-либо химической реакции, число эквивалентности равно: 1) для оксидов – произведению числа атомов элемента N на его валентность В, проявляемую в данном оксиде; 2) для кислот – ее основности, то есть числу атомов водорода, способных замещаться на катионы металлов; 3) для оснований – его кислотности, то есть количеству ионов ОН-, замещаемых на кислотные остатки при реакциях с кислотами; 4) для солей (средних) – произведению числа катионов NKt на элементарный заряд катиона ZKt. Таким образом, расчет молярной массы эквивалента вещества не участвующего в химической реакции следует вести по одной из формул: МЭ(оксида) = МЭ(кислоты) = Если вещество участвует в реакции ионного обмена, то z* принимают равным числу ионов Н+ или числу ионов ОН-, перешедших от одного вещества к другому, а молярная масса эквивалента рассчитывается по уравнению: МЭ = При расчете молярной массы эквивалента вещества, выполняющего роль окислителя (восстановителя) в окислительно-восстановительной реакции, число эквивалентности принимают равным количеству принятых (отданных) электронов Ne: МЭ = При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться не молярной эквивалентной массой, а молярным эквивалентным объемом вещества VЭ, то есть объемом, который при данных физических условиях занимает 1 моль эквивалентов газа. Расчет VЭ газа при нормальных условиях следует вести по формуле
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем при н.у. Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме, поэтому может возникнуть потребность в расчете молярной эквивалентной массы не молекулы, а иона. Для ионов МЭ вычисляют по формуле МЭ(иона) =
Пример 1. Вычислите молярную эквивалентную массу углерода в соединении CS2.
Р е ш е н и е Определяем степени окисления элементов в сероуглероде МЭ(С) =
Пример 2.Определите молярные эквивалентные массы следующих соединений: Н3РО3, Са(ОН)2, Na2CO3.
Р е ш е н и е 1. Основность фосфористой кислоты равна двум, тогда МЭ(Н3РО3) = 2. Кислотность гидроксида калия равна двум, следовательно МЭ(Са(ОН)2) = 3. Число катионов в карбонате натрия равно двум, а заряд катиона равен +1, значит МЭ(Na2CO3) = Пример 3.Вычислите молярные эквивалентные массы гидроксидов висмута и марганца, участвующих в реакциях 1) Bi(OH)3 + 2HNO3 = Bi(OH)(NO3)2 + 2H2O; 2) Mn(OH)2 + Cl2 + KOH ® MnO2 + KCl + H2O .
Р е ш е н и е 1. Реакция Bi(OH)3 + 2HNO3 = Bi(OH)(NO3)2 + 2H2O является ионно-обменным процессом, так как протекает без изменения степеней окисления элементов. В данном случае 1 моль гидроксида висмута обменивается с молекулами азотной кислоты двумя ионами ОН-, поэтому МЭ(Bi(OH)3) = 2. Реакция Mn(OH)2 + Cl2 + KOH ® MnO2 + KCl + H2O является окислительно-восстановительным процессом. С.О. атома марганца в гидроксиде равна +2, а в продукте реакции она составляет +4. Таким образом, атом марганца теряет два электрона в процессе окисления, тогда МЭ(Mn(OH)2) =
Пример 4. Вычислите молярный эквивалентный объем кислорода и водорода при н.у.
Р е ш е н и е 1. Газ Н2 состоит из двух атомов водорода. Эквивалент каждого атома Н равен 1, тогда
2. Газ О2 содержит 2 атома кислорода. Чаще всего С.О. кислорода в сложном веществе равна –2, следовательно, эквивалент О равен 0,5. Тогда
З А Д А Ч И 1. В какой массе гидроксида натрия содержится столько же эквивалентов, сколько в 140 г гидроксида калия? 2. Выразите в молях 3,01×1023 молекул аммиака. Определите молярную эквивалентную массу данного соединения. 3. Определите эквивалент и молярную массу эквивалента фосфора, кислорода и брома в соединениях фосфид водорода, вода, бромоводород. 4. Запишите реакцию образования гидрофосфата калия при взаимодействии ортофосфорной кислоты с гидроксидом калия. Вычислите молярную массу эквивалента кислоты в данной реакции. 5. Напишите уравнение реакции гидроксида железа (III) с соляной кислотой, при которой образуется хлорид дигидроксожелеза. Вычислите молярную массу эквивалента гидроксида в данной реакции. 6. Определите молярную эквивалентную массу серной кислоты и гидроксида меди (II) в реакциях: А) H2SO4 + NaOH = NaHSO4 + H2O; Б) Cu(OH)2 + 2HCl = CuCl2 + 2H2O. 7. Избытком КОН подействовали на раствор дигидрофосфата калия. Запишите уравнение реакции и определите молярную массу эквивалента исходной соли. 8. Вычислите молярные массы эквивалентов окислителя и восстановителя в окислительно-восстановительной реакции: SO2 + Cl2 + 2H2O = H2SO4 + 2HCl. 9. Вычислите молярную эквивалентную массу гидроксохлорида кадмия в реакции с хлороводородом. 10. Вычислите эквивалент и эквивалентную массу H3PO4 при взаимодействии с гидроксидом калия с образованием: а) гидрофосфата; б) дигидрофосфата. 11. Напишите уравнение реакций Ni(OH)3 с хлороводородной кислотой, при которых образуются следующие соединения никеля: а) дигидроксохлорид; б) гидроксохлорид; в) трихлорид. Вычислите эквивалент и эквивалентную массу Ni(OH)3 в каждой из этих реакций. 12. Определите эквивалент и эквивалентную массу металла в следующих соединениях: Mn2O7, Mg2P2O7, Ca3(PO4)2, Ba(OH)2. Вычислите молярные эквивалентные массы каждого вещества. 13. Вычислите эквивалентную массу следующих соединений: Al2(SO4)3, H2S, Na2S2O3, P2O5. 14. Вычислите эквивалент и эквивалентную массу серной кислоты при взаимодействии с гидроксидом калия с образованием а) гидросульфата калия; б) сульфата калия. 15. Вычислите эквивалент и эквивалентную массу гидроксида кальция при взаимодействии с хлороводородной кислотой с образованием а) гидроксохлорида кальция; б) хлорида кальция. 16. Вычислите эквивалент и эквивалентную массу оксида магния и алюминия в следующих реакциях: а) 2 НСl + MgO = MgCl2 + H2O; б) 6 HNO3 + Al2O3 = 2 Al(NO3)3 + 3 H2O. 17. Вычислите эквивалентную массу следующих соединений: Mn2O7, Na2S2O8, (CuOH)2CO3, (NH4)2Fe(SO4)2. 18. Вычислите эквивалентную массу следующих соединений: CuO, (NH4)2S, Ca(HCO3)2, AI(OH)2Cl. 19. Вычислите эквивалентную массу следующих соединений: SnO2, Al2S3, SiH4, Fe(SCN)3, Cr2(HPO4)3. 20. Определите эквивалент и эквивалентную массу фосфора в следующих соединениях: РН3, Р2О5, Р2S3, КН2РО2. 21. Определите эквивалент и эквивалентную массу азота в следующих соединениях: а) аммиак; б) нитрат калия; в) нитрит калия; г) нитрид калия. 22. Определите эквивалент хлора и кислорода в следующих оксидах: Cl2О, Cl2О3, Cl2О5, Cl2О7. Эквивалент какого элемента остается постоянным и почему? 23. Сера образует три оксида, определите эквивалент серы и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему? 24. Хром образует три оксида, определите эквивалент хрома и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему? 25. Определите эквивалент и эквивалентную массу следующих кислот: а) ортофосфорная; б) фосфорноватая. 26. Определите эквивалент и эквивалентную массу следующих кислот: а) метафосфорная; б) фосфорноватистая. 27. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях: а) NO3 - ® NO2; б) S2O8 2- ® 2 SO42-. 28. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях: а) NO3- ® NH4+; б) SO32- ® SO42-. 29. Определите эквивалент и эквивалентную массу марганца в полуреакциях: а) MnO4- ® MnO2; б) MnO42- ® MnO4 -. 30. Определите эквивалент и эквивалентную массу хрома в полуреакциях: а) CrO2- ® CrO42-; б) Cr2O72- ® 2Cr3+.
ЗАКОН ЭКВИВАЛЕНТОВ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ,
, .
. .
. , МЭ(соли) =
, МЭ(соли) =  ,
, , МЭ(основания) =
, МЭ(основания) = 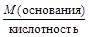 .
. =
=  .
. .
. , дм3/моль,
, дм3/моль, .
. 2. Тогда
2. Тогда .
.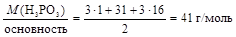 .
.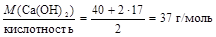 .
. .
. = 130 г/моль.
= 130 г/моль.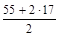 = 44,5 г/моль.
= 44,5 г/моль. ;
; .
.