
|
|
Расчет концентрации ионов водорода и гидроксид-ионов в растворах гидролизующихся солейБольшинство солей, растворимых в воде, являются сильными электролитами и в растворе полностью распадаются на ионы. Если в состав соли входят ионы, соответствующие образованию слабой кислоты или слабого основания, то эти ионы могут конкурировать с молекулами воды за обладание ионами Н+ и ОН–: М+ + НОН ↔ МОН + Н+ (24) А– + НОН ↔ НА + ОН– (25) Такие реакции называются реакциями гидролиза ионов (по катиону (24) и по аниону (25)). Очевидно, что если в состав соли входят ионы, соответствующие образованию только сильной кислоты и основания, то эти ионы не гидролизуются. Например, не подвергаются гидролизу соли Na2SO4, KCl, Ba(NO3)2 и т.д. Хлорида аммония NH4Cl содержит ион, соответствующий слабому основанию NH4OH, поэтому гидролиз протекает по катиону: NH4Cl → NH4+ + Cl– NH4+ + HOH ↔ NH4OH + H+ NH4Cl + HOH ↔ NH4OH + HCl. Раствор хлорида аммония будет иметь рН < 7. Реакция гидролиза протекает обратимо и описывается константой гидролиза:
В состав нитрита калия входит ион NO2–, который соответствует слабой кислоте HNO2. В этом случае гидролиз протекает по аниону: KNO2 → K+ + NO2– NO2– + HOH ↔ HNO2 + OH– KNO2 + HOH ↔ HNO2 + KOH. рН раствора нитрита калия больше 7. Константа гидролиза этой соли имеет следующий вид:
Нитрит аммония образован и слабым основанием, и слабой кислотой, поэтому гидролиз будет идти и по катиону, и по аниону: NH4NO2 → NH4+ + NO2– NH4+ + HOH ↔ NH4OH + H+ NO2– + HOH ↔ HNO2 + OH– В данном случае степень гидролиза сильно возрастает, так как образующиеся ионы водорода и гидроксила связываются в воду, и равновесие реакции гидролиза смещается вправо: NH4+ + NO2– + HOH ↔ HNO2 + NH4OH NH4NO2 + HOH ↔ HNO2 + NH4OH. Для определения рН раствора такой соли необходимо сравнить константы диссоциации обоих слабых электролитов: HNO2 и NH4OH. К(HNO2) = 4,3·10–4, а К(NH4OH) = 1,75·10–5. Константа диссоциации гидроксида аммония меньше, чем константа диссоциации азотистой кислоты, поэтому ион аммония будет гидролизоваться в большей степени, и рН раствора будет меньше 7.
Задача 8 Навеску соли S1 (молярная масса М г/моль) массой m (г), растворили в мерной колбе на V (мл) и разбавили водой до метки. Рассчитайте рН полученного раствора и степень гидролиза растворенной соли, если соответствующая константа диссоциации равна К (таблица 15). Таблица 15 – Условие задачи 8
Продолжение таблицы 15
Продолжение таблицы 15
Рассмотрим решение задачи на примере 1 варианта. Запишем реакцию гидролиза ацетата калия: Сc Сc Сc CH3COOK → CH3COO– + K+ Сc –х х х CH3COO– + HOH ↔ CH3COOH + OH– Обозначим начальную концентрацию соли Сс. Поскольку это вещество сильный электролит, в результате его диссоциации образуется столько же ацетат-ионов (С(СH3COO–) = Сc). Реакция гидролиза протекает обратимо. Если в реакцию гидролиза вступает х моль/л ионов CH3COO–, то образуется х моль/л молекул уксусной кислоты и х моль/л ионов OH– и остается (Cc – х) моль/л ионов CH3COO–. Запишем выражение константы гидролиза для этой соли:
Если константа гидролиза соли мала, то можно считать, что х<<Сс. Тогда уравнение (26) примет вид:
Если константа гидролиза велика, то для нахождения х необходимо решить следующее уравнение:
Рассчитаем концентрацию соли по формуле (2):
Найдем константу гидролиза:
Константа гидролиза мала и для расчета концентрации ионов ОН– можно использовать уравнение (27):
Рассчитаем степень гидролиза:
В варианте 2 константа диссоциации кислоты мала и соответственно, константа гидролиза соли, образованной это кислотой, будет велика, поэтому для расчета величины х необходимо использовать уравнение (28). Ортофосфат калия образован так же, как и в предыдущем примере, сильным основанием и слабой кислотой и гидролизуется по аниону; рН такого раствора будет больше 7. Рассчитаем константу гидролиза:
Найдем концентрацию соли и концентрацию ионов OH– в растворе:
Рассчитаем рН раствора ортофосфата натрия: рН = 14 – рОН = 14 + lg 1,100∙10–2 = 12,0412. Степень гидролиза этой соли будет равна:
Таблица 16 – Ответы к задаче 8
Задача 9 Рассчитайте растворимость соли S1 (моль/л и г/100 г раствора, ρ = 1 г/мл) в чистой воде и в С1 молярном растворе соли S2. Произведение растворимости S1 равно ПР. Можно ли использовать это вещество в гравиметрическом методе анализа? Таблица 17 – Условие задачи 9
Пример решения задачи 9 (вариант 2). Запишем уравнение растворения малорастворимой соли: 3х х Cs3Co(NO2)6 ↔ 3Cs+ + Co(NO2)63– Произведение растворимости для этого процесса имеет следующий вид: ПР = [Cs+]3·[Co(NO2)63–]. Пусть растворилось соли х моль/л, тогда образовалось 3х моль/л Cs+ и х моль/л Co(NO2)63–. Подставим эти обозначения в произведение растворимости: ПР = (3х)3 · х = 27х4 = 6·10–16.
Растворимость соли Cs3Co(NO2)6 равна 6,87∙10–5 (моль/л). М(Cs3Co(NO2)6) = 733,678 г/моль. Это соответствует: 6,87∙10–5·733,678/10 = 5,04·10–3 (г/100г раствора). При добавлении 0,005 молярного раствора хлорида цезия получаем: 3х х Cs3Co(NO2)6 ↔ 3Cs+ + Co(NO2)63– 0,005 0,005 0,005 CsCl → Cs+ + Cl– Общая концентрация ионов Cs+ в растворе будет равна (0,005 + 3х), так как х мал, будем считать, что выражение (0,005 + 3х) = 0,005. Выражение произведения растворимости примет вид: ПР = 0,0053∙х = 1,25∙10–7·х = 6·10–16, отсюда х = 4,80·10–9 (моль/л). Это соответствует 4,80·10–9 · 733,678/10 = 3,52·10–7 (г/100г раствора). Проанализируем возможность использования этого вещества в качестве весовой формы в гравиметрическом анализе. Масса вещества, оставшаяся в растворе, не должна превышать погрешность взвешивания, т.е. быть меньше, чем 2∙10–3 г. Растворимость соли в чистой воде равна 5,04·10–3 г/100 г раствора. Соответственно при осаждении соли в 100 г раствора останется 5,04·10–3 г вещества, что превышает допустимый предел. Однако при добавлении хорошо растворимой соли, содержащей одноименный ион (избыток осадителя), наблюдается значительное уменьшение растворимости, и потери вещества составят лишь 3,52·10–7 г, что значительно превышает точность гравиметрического анализа.
Таблица 18 – Ответы к задаче 9 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 (26)
(26) (27)
(27) (28)
(28) (моль/л).
(моль/л). .
. (моль/л).
(моль/л).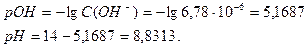

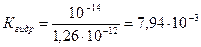 .
.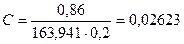 (моль/л).
(моль/л). (моль/л).
(моль/л).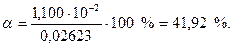
 .
.