
|
|
Константа химического равновесияЗависимость теплового эффекта реакции от температуры. Закон Кирхгофа В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на химической реакции обычно пренебрегают; влияние температуры на величину теплового эффекта описывается формулой Кирхгофа. Имея в виду в первую очередь зависимость H = f(T), рассмотрим изменение энтальпии в ходе некоторой реакции
Каждому из участников реакции присуще определённое мольное значение энтальпии Hi, суммирующееся из мольной внутренней энергии Ui и произведения давления на молярный объём PVi. Тогда тепловой эффект реакции можно представить в виде алгебраической суммы:
Для нахождения зависимости H = f(T) продифференцируем уравнение (34) по температуре при постоянном давлении:
Производная мольной энтальпии вещества по температуре при P = const представляет собой мольную теплоёмкость этого вещества при постоянном давлении:
Поэтому
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции. Разделив переменные в уравнении (37) и проинтегрировав его, получаем:
Здесь ΔHJ – постоянная интегрирования. При определённом интегрировании от Т1 до Т2 получим:
Если считать ΔСP не зависящим от температуры, уравнение (39) преобразуется к виду:
Поскольку обычно известны табличные значения стандартных тепловых эффектов ΔН°298, преобразуем выражение (40):
Для более точных расчётов необходимо учитывать зависимость молярных теплоёмкостей от температуры. Поскольку теория теплоёмкости до настоящего времени окончательно не разработана, для описания температурной зависимости теплоёмкостей веществ используются эмпирические формулы, представляющие теплоёмкости в виде степенного ряда:
С учётом зависимости СР = f(Т) уравнения (38) и (40) преобразуются к виду:
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В общем случае направление и предел самопроизвольного протекания процесса в любых системах определяет принцип минимума свободной энергии: Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения. Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса и Гельмгольца соответственно). Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изэнтропный) и энтальпия (изобарно-изэнтропный потенциал). Протекание самопроизвольного процесса в закрытой системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0). Очевидно, что рано или поздно (напомним, что понятие "время" в термодинамике отсутствует) система достигнет минимума свободной энергии. Условием минимума некоторой функции Y = f(x) является равенство нулю первой производной и положительный знак второй производной: dY = 0; d2Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала: Изобарно-изотермические (P = const, T = const): ΔG=0 dG=0, d2G>0 Изохорно-изотермические (V = const, T = const): ΔF=0 dF=0, d2F>0 Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия: Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом. Учение о равновесных состояниях – один из разделов термодинамики. Далее мы будем рассматривать частный случай термодинамического равновесного состояния – химическое равновесие. Как известно, многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне.
Константа химического равновесия Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. На основании уравнения состояния идеального газа, записанного в виде соотношения Pi = CiRT, где Сi = ni/V, и закона Дальтона для идеальной газовой смеси, выраженного уравнением P = ΣPi , можно вывести соотношения между парциальным давлением Pi, молярной концентрацией Сi и мольной долей Xi i-го компонента:
Отсюда получаем соотношение между Kc, Kp и Kx:
Здесь Δν – изменение числа молей газообразных веществ в течение реакции: Δν = – ν1 – ν2 – ... + ν'1 + ν'2 + ... Величина константы равновесия Kx, в отличие от констант равновесия Kc и Kp, зависит от общего давления Р. Выражение для константы равновесия элементарной обратимой реакции может быть выведено из кинетических представлений. Рассмотрим процесс установления равновесия в системе, в которой в начальный момент времени присутствуют только исходные вещества. Скорость прямой реакции V1 в этот момент максимальна, а скорость обратной V2 равна нулю:
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие. Приняв, что V1 = V2, можно записать:
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л. Приведённый вывод выражения для константы равновесия, однако, исходит из ложной в общем случае посылки, что скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Как известно, в общем случае показатели степени при концентрациях реагентов в кинетическом уравнении химической реакции не совпадают со стехиометрическими коэффициентами.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 (34)
(34) (35)
(35)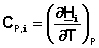 (36)
(36)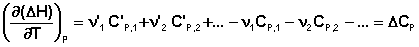 (37)
(37)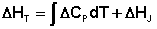 (38)
(38)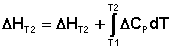 (39)
(39)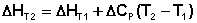 (40)
(40)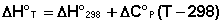 (41)
(41)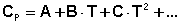 (42)
(42)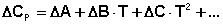 (43)
(43) (44)
(44)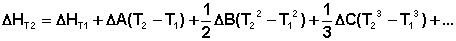 (45)
(45)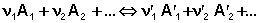
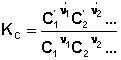 (1)
(1)  (2)
(2)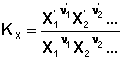 (3)
(3)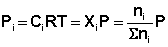 (4)
(4) (5)
(5)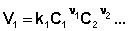 (6)
(6) (7)
(7)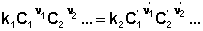 (8)
(8)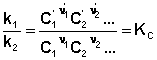 (9)
(9)