
|
|
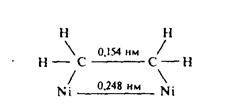
Мультиплетная теория гетерогенного катализа (А.А.Баландин)В образовании поверхностного соединения (мультиплетного комплекса) участвуют группы активных атомов поверхности – т.н. мультиплеты (дуплеты, триплеты, квадруплеты и т.д.) Мультиплеты обладают определенными геометрическими и энергетическими свойствами Строение мультиплета отвечает принципам геометрического и энергетического соответствия. Принцип геометрического соответствия – твердое тело может быть гетерогенным катализатором, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагирующих веществ. Расстояние между атомами в мультиплете должно соответствовать расстоянию между атомами (длине химической связи) в реагирующих молекулах, образующих на поверхности катализатора мультиплетный комплекс.
Содержание Физическая химия. 2 Термодинамика. 2 Введение. 2 Историческая справка. 2 Задачи термодинамики. 3 Понятия и определения. 3 Внутренняя энергия системы.. 4 Теплота и работа. 5 Первый закон термодинамики. 6 Применение первого закона термодинамики к процессам в идеальных газах. 7 Теплоемкость. 9 Приближенные правила расчета теплоемкости. 10 Зависимость теплоемкости от температуры.. 11 Теории теплоемкости. 11 Классическая кинетическая теория. 11 Теория теплоемкости Эйнштейна-Дебая (квантовая теория) для твердого вещества 1907 г. 12 Усовершенствования в теорию Эйнштейна внес Дебай. 13 Квантовостатистическая теория газов. 13 Тепловые эффекты химических реакций. 14 Закон Гесса. Вычисление теплового эффекта химической реакции при обычных условиях. 14 Вычисление теплового эффекта методом алгебраического суммирования термохимических уравнений 15 Вычисление теплового эффекта графическим методом (методом термохимических схем) 15 Вычисление теплового эффекта по стандартным энтальпиям образования. 16 Вычисление теплового эффекта реакций в водных растворах по стандартным энтальпиям образования 16 Вычисление теплового эффекта по стандартным энтальпиям сгорания. 17 Вычисления общего количества теплоты, необходимого для нагревания вещества. 17 Зависимость теплового эффекта реакции от температуры.. 17
Определение энтропии по Больцману (термодинамическая вероятность) 22 Изменение энтропии в некоторых процессах. 22 Изменение энтропии при фазовых превращениях. 22 Изменение энтропии при изотермическом расширении (сжатии) 1 моль идеального газа. 23 Изменение энтропии при нагревании системы.. 23 Изменение энтропии при кристаллизации переохлажденной жидкости. 24 Изменение энтропии химической реакции. 24 Изменение энтропии идеального газа. 24 Термодинамические потенциалы.. 25 Характеристические функции. 27 Уравнения Гиббса-Гельмгольца. 28 Третий закон термодинамики. 28 Парциальные молярные величины.. 29 Уравнения Гиббса-Дюгема. 30 Следствия из уравнений Гиббса-Дюгема. 31 Относительные ПМ свойства. 33 Кажущиеся молярные величины.. 33 Методы определения парциальных молярных величин. 34 Химический потенциал. 35 Зависимость химического потенциала от температуры.. 36 Химический потенциал в газах. 37 Химический потенциал в растворах. 39 Химическое равновесие. 44 Константа равновесия. Закон действующих масс. 44 Использование закона действующих масс для расчета состава равновесной газовой смеси. 45 Уравнение изотермы химической реакции (влияние состава на равновесие) 47 Принцип Ле-Шателье и влияние различных факторов на химическое равновесие. 48 Уравнение изобары химической реакции. 49 Метод приведенных энергий Гиббса. 50 Метод Темкина-Шварцмана. 50 Равновесие в гетерогенной системе. 50 Условие равновесия в гетерогенной системе. 50 Константа равновесия гетерогенной системы.. 51 Фазовые равновесия. 52 Основные понятия и определения. 52 Правило фаз Гиббса. 53 Уравнение Клаузиуса-Клапейрона. 54 Применение уравнения Клаузиуса-Клапейрона к различным процессам.. 55 Равновесия с участием растворов. 56 Термодинамические условия образования растворов. 58 Закон Рауля. 58 Растворимость газов. 60 Растворимость твердых веществ. Уравнение Шредера. 61 Зависимость растворимости твердых веществ от давления. 62 Температура кипения раствора. 63 Температура замерзания раствора. 65 Осмотическое давление. 67 Фазовые диаграммы.. 69 Однокомпонентные системы.. 69 Двухкомпонентные системы.. 71 Двухкомпонентные неконденсированные системы.. 72 Двухкомпонентные конденсированные системы.. 81 Построение диаграмм.. 81 Типовые диаграммы состояния конденсированных систем.. 83 Трехкомпонентные конденсированные системы.. 87 Треугольник Гиббса. 88 Метод Розебума. 89 Правило луча. 90 Сечения объемной диаграммы.. 92 Проекция нескольких сечений. 95 Водно-солевые системы.. 104 Электрохимия. 107 Введение. 107 Историческая справка о науке электрохимии. 107 Растворы электролитов. 108 Основные понятия и определения. 108 Историческая справка о природе растворов электролитов. 109 О сольватации и ассоциации. 110 Ассоциация. 110 Сольватация. 111 Термохимическая теория растворения электролитов. 113 Теория гидратации Борна. 115 Метод активностей. 116 Теория Дебая-Хюккеля. 119 Электрическая проводимость растворов. 123 Введение. 123 Зависимость электропроводности от температуры.. 124 Движение ионов в электрическом поле. Числа переноса ионов. 125 Зависимость удельной электрической проводимости растворов электролитов от концентрации. 126 Про электропроводность ионов H+ и OH−. 130 Метод кондуктометрии. 130 Термодинамика электродных систем.. 132 Введение. 132 Закон Фарадея. 132 Электроды, цепи, их схематическая запись. 133 Правила записи электродов и цепей. 134 Возникновение скачка потенциала на границе раствор-металл. 135 Двойной электрический слой. 136 Потенциал нулевого заряда. 138 Стандартные потенциалы.. 138 Уравнение Нернста и направление протекания ОВР. 138 (термодинамика обратимых электрохимических систем) 138 Типы электродов. 139 Электрохимические цепи. 140 Химические цепи. 140 Работа аккумулятора. 141 Концентрационные цепи. 142 Коррозия. 142 Химическая кинетика. 143 Введение. 143 Основные понятия и определения. 143 Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс. 145 Порядок реакции. 146 Принцип независимости протекания химических реакций. 146 Кинетика закрытых систем.. 147 Простые реакции. 147 Односторонняя реакция первого порядка. 147 Односторонние реакции второго порядка. 148 Односторонние реакции третьего порядка. 150 Определение порядка реакции и константы скорости реакции. 150 1. Метод подстановки. 150 2. Графический метод. 151 3. Метод времени полупревращения. 151 4. Метод Вант-Гоффа. 151 5. Метод избытка. 152 Сложные реакции. 152 Двусторонние (обратимые) реакции. 152 Параллельные реакции первого порядка. 154 Последовательные реакции первого порядка. 155 Сопряженные реакции. 156 Автокаталитические реакции. 157 Цепные химические реакции. 158 Вероятностная теория цепных реакций. 160 Горение и взрыв. 161 Цепной взрыв или воспламенение. 161 Тепловой взрыв. 162 Формальная кинетика открытых систем. Приближение формально простых и элементарных процессов 163 Модель реактора идеального смешения. 163 Модель реактора идеального вытеснения. 165 Влияние температуры на скорость реакции. 166 Правило Вант-Гоффа. 166 Уравнение Аррениуса. 166 Теоретические основы расчета констант скорости химической реакции. 167 Теория активных столкновений. 167 Теория активированного комплекса. 169 О поверхности потенциальной энергии элементарного химического акта. 169 О расчете скоростей элементарных реакций. 171 Константа скорости реакции и термодинамические параметры активированного комплекса. 174 Кинетика гетерогенных процессов. 175 Уравнения Фика. 176 Нестационарная диффузия. 177 Модель нестационарной линейной полубесконечной диффузии. 177 Модель нестационарной сферической полубесконечной диффузии. 178 Стационарная конвективная диффузия. 178 Определение лимитирующей стадии (реакция или диффузия?) 180 Электролиз. 181 Порядок восстановления катионов. 181 Порядок окисления анионов. 182 Кинетика электродных процессов (поляризация и перенапряжение) 182 Электродная поляризация. 183 Диффузионное перенапряжение. Уравнение Нернста-Бруннера. 185 Электрохимическое перенапряжение. 187 Перенапряжение при электролитическом выделении водорода. 187 Катализ. 188 Основные принципы каталитического действия. 189 Слитно или раздельно?. 189 Кинетические уравнения каталитических реакций. 190 Энергия активации каталитических реакций. 192 Соотношение между эффективной и истинной энергиями активации. 192 Специфичность катализа. 193 Активность и селективность катализатора. 193 Гомогенный катализ. 194 Кислотно-основной катализ. 194 Общий кислотно-основной катализ. 195 Специфический кислотно-основной катализ. 196 Гетерогенный катализ. 197 Общие слова. 197 Виды гетерогенных катализаторов. 197 Старение и отравление катализаторов. 198 Основные стадии гетерогенно-каталитического процесса. 199 Закон действующих поверхностей. 199 Уравнения адсорбции. 200 Основные кинетические уравнения гетерогенного катализа. 202 Примеры типовых схем.. 202 Мультиплетная теория гетерогенного катализа (А.А.Баландин) 206

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|



 Второй закон термодинамики. Энтропия. 20
Второй закон термодинамики. Энтропия. 20